細胞治療のcGMP開発・製造サービス
技術力・専門知識とアジャイルな業務遂行能力の融合により、各プロジェクトのニーズを的確に満たします
細胞治療は患者にとって新たな治療のパラダイムを提供する魅力的な選択肢ですが、その商業的成功を制限する複雑な要因が数多く存在します。これには、分析、スケーラビリティ、規制のハードルなどが含まれます。サーモフィッシャーサイエンティフィックでは、これらの課題を共に乗り越えるために、開発と製造戦略における個別対応の重要性を認識しています。私たちはフルサービスの細胞治療CDMOパートナーとして、臨床から商業化段階に至るまで、お客様を支援するプロセス開発、分析開発、cGMP製造を提供しています。
初期段階のお客様に対しては、当社のトランスレーショナルサービス チームが、標準化されたプロセスと資格化可能な分析の早期確立を通じて、細胞治療研究の迅速かつ効果的な移行を可能にします。これにより、これらのプロセスは当社のcGMP施設にシームレスに移管されます。
さまざまなモダリティにおける経験
さまざまなモダリティのためのサポートシステムと技術力・専門知識の土台を構築いたします。
- 自家・他家細胞治療
- ウイルス・非ウイルス修飾遺伝子送達システム
- T細胞、NK細胞、人工多能性幹細胞(iPSC)、間葉系幹細胞(MSC) 、抗原提示細胞 (APC)、ヒト胚性幹細胞(hESC)、血液および骨髄由来の幹細胞など
革新的な製造ソリューションで迅速な進化をサポート
Patheonファーマサービスの一環として、私たちは20年以上にわたり医薬品製造の分野で活動しており、急速に進化する業界のニーズに応えるための専門知識と柔軟性を備えています。当社の製造準備アプローチは、スピードと品質、そして革新性のバランスを重視しています。
私たちの**Rapid Development Framework™**は、さまざまな細胞タイプと分析に対応するために確立された最適化プロセスと、カスタマイズ可能なコンポーネントで構成されています。これにより、お客様は効率的かつ信頼性の高い標準化された要素を活用しながら、プロジェクトのコントロールを維持できます。また、お客様の独自の治療製品に合わせた新しいソリューションを共同開発することも可能です。
cGMP製造への移行が準備できた際には、カリフォルニア州サンフランシスコにある最先端の施設で、お客様ごとのニーズに応じて設定可能な個別スイートを提供し、プロセスの効率を最大化します。これにより、商業化に向けた長期的なスケーラビリティが確保されます。
総合的なアプローチによる細胞治療サービス
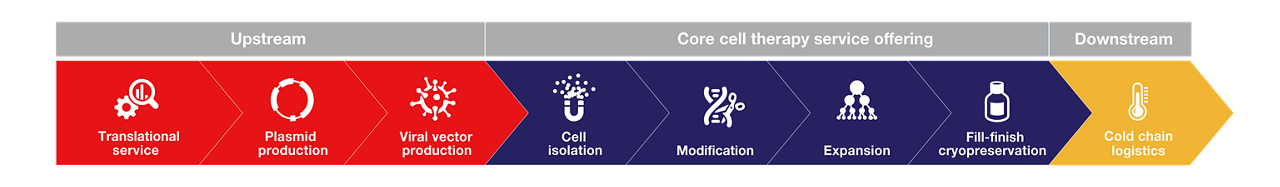
コアサービスで細胞治療の製造に加え、さまざまな上流・下流サービスにより開発のあらゆる側面を支援いたします。小スケールでのプロセス最適化をサポートする初期トランスレーショナルサービスから最終製品の円滑な保管・物流を確保する低温ロジスティクスサービスまでカバーするワンストップのソリューションにより、お客様の細胞治療のプロジェクトのニーズを的確に満たします。
私たちのチームは、プロセスの最適化、検証、確認を含む系統的なアプローチで臨床および商業化の準備を進め、最終的に時間を節約しコストを削減します。以下に、当社の細胞治療プロセス開発サービスの主な要素をご紹介します。
- プロセスの最適化、スケールアップ、容量モデリング
- プロセスと製品の特性評価
- 自動化や既存プロセスのクローズ化の機会の評価
- 凍結保存の配合開発と制御凍結
- 製品の比較性と安定性試
- クローズドシステムによる細胞分離、洗浄、体積減少ステップ
- 製造ワークフローのcGMPスイートへの移行

- 発物質、中間製品、最終製品のモニタリングとサンプル採取
- 業界基準を遵守した分析法
- 正確な製品特性評価のための分析法の開発、バリデーション、適格性評価

先進医療の規制環境は進化し続けており、現在妥当であっても明日には不適切なものとなっている可能性があります。15年以上にわたって、世界各国(米国、EU、カナダ)の規制当局との交渉、CMCに関する規制・ガイドライン・査察を支援してきた経験を誇る規制対応チームが、文書レビューやギャップ分析のほか、申請資料の作成サービスも提供し、仲介業者数とリードタイムの削減を実現いたします。
- CMC資料の作成
- ギャップ分析、CMC資料レビュー
- CMC規制対応戦略のコンサルティング
- 規制当局との面談、申請、査察サポート
- 変化し続ける規制ガイドラインへの的確な対応
44,000平方フィートの敷地に整備した最先端施設は、サンフランシスコ湾岸地帯の数多くの癌専門病院に隣接しており、サンフランシスコ国際空港からは約15分の位置にあります。個別ニーズに合わせて柔軟にユーザー設定可能なcGMP製造スイートは、それぞれ専用のHVACシステムを備えているため、複数の細胞株/製品を同時にサポートすることが可能です。
Helpful Resources

Fact Sheet
Cell and gene therapy solutions fact sheet
The cell and gene therapy market is experiencing accelerated market approval opportunities, record breaking investments, robust therapeutic pipelines, and positive clinical outcomes – all driving the need for speed, regulatory know-how, and innovation in manufacturing technologies.
View Fact Sheet
Webinar
Optimizing the cell therapy patient journey through integrated CRO CDMO partnership
Watch this on-demand webinar for insights on how working with a single integrated CRO/CDMO partner can help ease industry challenges and provide an accelerated path from development to manufacturing, as well as the benefits that come from unified teams and infrastructure.
Watch Webinar
Video
Autologous and allogeneic therapies - today and tomorrow: Exploring the science, manufacturing and regulatory considerations
In this roundtable discussion, clinical and commercial experts address the complex dynamics associated with allogeneic vs. autologous cell therapies and offer insight into the current and future state of the industry. Specific topics include best practices for manufacturing and logistics, regulatory landscape and CMC requirements, and the role of standardization.
Watch Video
Infographic
Cell therapy manufacturing workflow
View our new infographic for an overview of a genetically modified cell therapy workflow and the key considerations at each step, ranging from plasmid production through cold chain logistics.

eBook
Cell and gene therapies in the US vs. the EU: Top five areas of differentiation
In this eBook we share the five key differences in the drug development and review process for companies hoping to gain market access through US Food and Drug Administration (FDA) or European Medicines Agency (EMA) approval—as well as tips for navigating these differences.
View eBook
Webinar
Key considerations when selecting a CDMO partner for cell therapy manufacturing
Like many therapeutic manufacturing workflows, every step in the mRNA process builds upon the prior step. This infographic explores each intertwined step in the mRNA manufacturing process and outlines how Thermo Fisher Scientific’s flexible approach can get your mRNA product to clinic and market faster.
Watch Webinar