無菌充填(Fill Finish)サービス
注射剤製造工程の最終段階を効率化
バイオ医薬品および低分子医薬品のFirst-in-Human(FIH)試験から商用スケールの製造までをカバーする高い実績を誇るリーディングカンパニーが、上市最速化を支援いたします。凍結乾燥製剤をはじめとする数多くの剤形・製剤処方の選択肢を整備し、製品ライフサイクルの各ステージに最適な製剤を製造いたします。
cGMP準拠施設が提供する柔軟性の高い無菌充填(Fill Finish)サービスでは、バイオ医薬品、mRNA医薬品などさまざまな分子の無菌充填を行うとともに、前臨床試験用のnon-cGMP条件下での製造にも対応可能です。数多くのプロジェクトを支援し、新薬承認申請/生物製剤承認申請(NDA/BLA)承認取得に貢献してきたグローバルチーム・薬事エキスパートの力を是非ご利用ください。
バイアル、プレフィルドシリンジ、カートリッジの無菌充填(Fill Finish)サービス
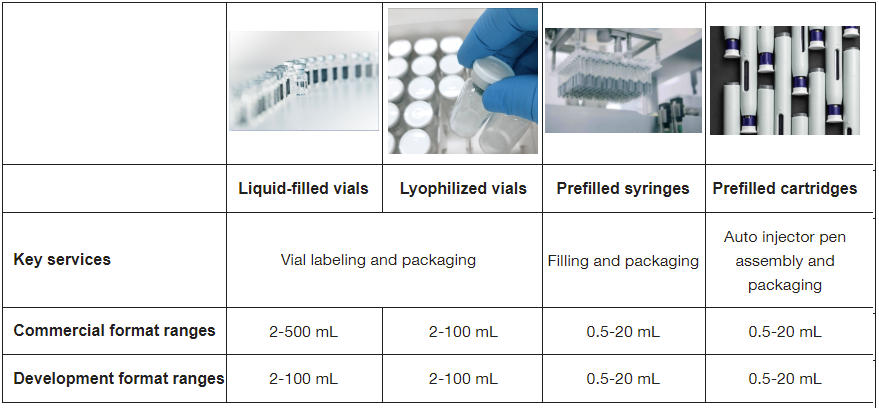
前臨床からFirst-in-Human(FIH)試験、そして後期臨床試験へと開発の進捗に応じて、各分子のニーズを的確に満たす幅広い無菌注射剤を提供いたします。
 |
 |
 |
 |
|
| 主なサービス | ||||
| 商用の容量範囲 | ||||
| 開発用の容量範囲 | ||||
米国、EUをはじめとする世界各地に製造拠点を整備しています。各拠点に関する情報は、各地域の営業担当者にお問い合わせください。
注射剤の無菌充填(Fill Finish)
注射剤の処方開発から上市まで、注射剤製造をリードする医薬品受託製造開発機関(CDMO)にお任せください。数十年にわたって培った経験を誇るエキスパートチームが、製品ライフサイクルのあらゆる段階を支援し、ニーズの変化に応じたさまざまな注射剤を製造いたします。
適切な処方開発には時間がかかることがあり、スケジュールに遅れが生じる余裕が全くないときにも手間取る可能性があります。化合物の化学的性質によっては、温度やせん断に敏感であることや難溶性、高薬理活性などが大きな課題となることがあります。凍結乾燥製剤が望ましい場合にも、サイクルの最適化が必要となります。
パセオンでは以下のステップからなる注射剤処方開発プロセスを確立しています。
1. プレフォーミュレーション: 至適pH、イオン強度、分解経路、安定性試験
2. 処方開発: 一時一事実験(OFaT)や実験計画法(DoE)を用いて添加剤を選択し、それぞれの最適な配合量を決定します。
3. 処方確認: 選択された最終処方の安定性について、分析ツールを用いて確認します。
処方サービスの詳細については、以下をご覧ください。

前臨床試験および第I相試験におけるコスト削減・品質確保
前臨床試験および第I相試験には時間がかかることがあり、スケジュールの長期化はコスト増につながります。初期開発では、開発の進捗に伴ってすべてのプロセスの品質と一貫性を確保することが極めて重要です。凍結乾燥製剤とすること、non-cGMPバッチを使用すること、適格性確認済みの構成部品を使用することにより、品質と一貫性の双方の懸念を解消することが可能です。凍結乾燥では、安定性が高まり、臨床試験期間をカバーできる長い有効期間を得ることができます。
時間とコストの削減を実現するnon-cGMP製造施設では、設備のスケーラビリティを確保しています。non-cGMP製造ラインは、cGMP製造ラインをほぼ再現した設定であり、cGMP製造に伴う無菌操作とコストがないこと以外は同一です。
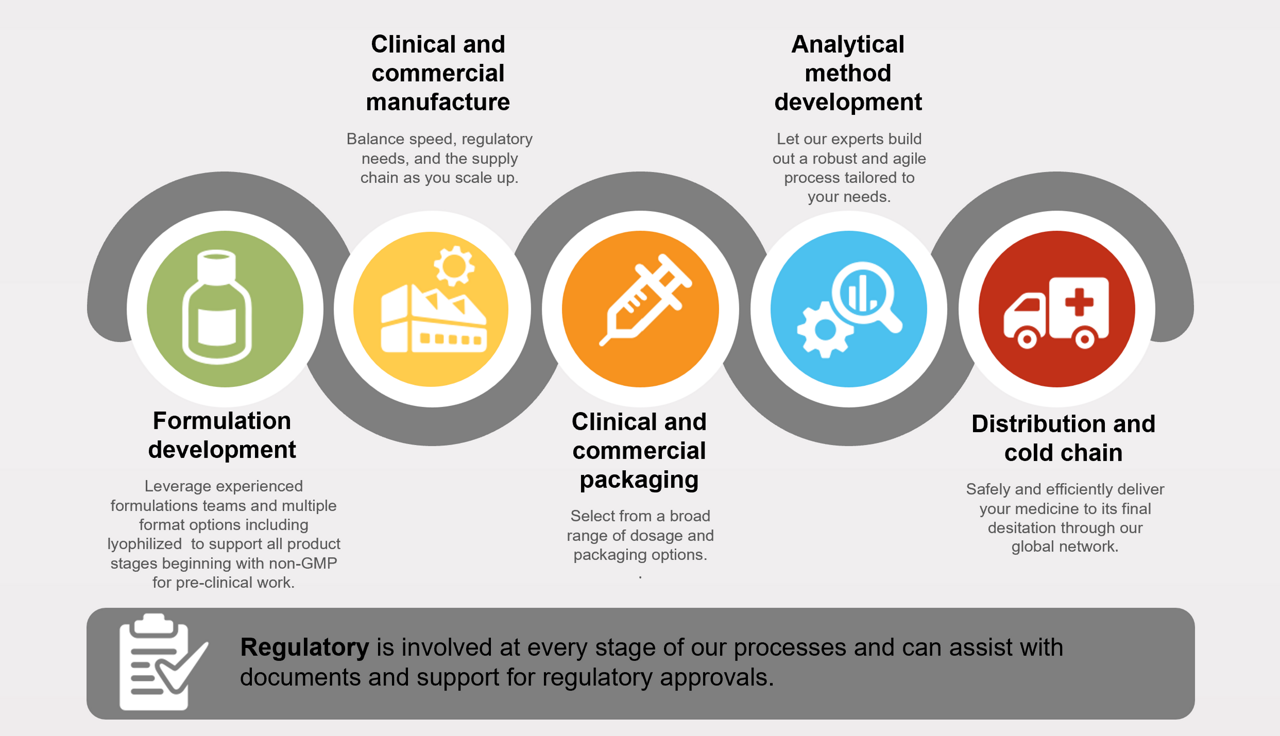
承認取得の可能性を最大限に高めるため、パセオンファーマサービスは、スピード、規制遵守、サプライチェーンのバランスを取りながらスケールアップを進めます。以下を実現できるパセオンファーマサービスの力をご利用ください。
- 世界各地の複雑な規制環境への的確な対応
- 上市最速化
- スピーディーかつ高効率の技術移管
- グローバルネットワークを駆使した頑健なサプライチェーンの確保


特定の剤形を開発することが決まっている場合でも、さまざまな選択肢を検討している場合でも、幅広い包装を提供できるパセオンにお任せください。1年間で製造した無菌液剤・凍結乾燥製剤バイアルは1億3千万本以上、剤形は40種類にのぼるパセオンでは、適格性確認済みの構成部品と標準化されたプロセスを数多く整備しています。
サービス内容は以下のとおりです。
- 小容量・大容量注射剤
- 液剤充填バイアル
- 凍結乾燥製剤バイアル
- ISO規格品を含むさまざまなサイズのバイアル
- プレフィルドシリンジ・カートリッジ
製品ライフサイクルを通した長期的成功の土台を構築いたします。お客様のニーズに合わせ、頑健かつアジャイルなプロセスを開発するエキスパートの力をご利用ください。
- 凍結乾燥サイクルプロセスの開発・最適化
- 製造プロセス開発試験
- 混合およびポンプせん断
- ホールドタイム試験
- 凍結融解試験
- スケーラビリティ試験
- 製品接触部品の適合性
- 立証された許容範囲(PAR)
- 医薬品規制調和国際会議(ICH)ガイドラインに準拠した安定性試験
- 輸送容器の選択
- 構成部品の適合性試験
- 洗浄バリデーション
- 使用中の安定性試験
- 滅菌サイクルの開発・バリデーション

30年以上にわたって治験サービスを提供してきた経験を駆使し、治験薬を安全に、かつ、スケジュールを厳守して配送いたします。従来の低分子医薬品、バイオ医薬品、先進治療などあらゆる治験薬の戦略構築、調達、管理、包装・ラベリング、保管、流通をサポートするサービスをご利用ください。治験関連サービスの詳細はこちらをご覧ください。
コールドチェーン(低温物流)、ロジスティクス、管理
製品の完全性を維持し、すぐに使用できる状態で目的地までお届けします。包括的な拠点間連携を確保したグローバルネットワークにより、信頼性の高い保管、包装・ラベリング、輸送サービスを提供いたします。
低温・超低温サプライチェーン管理・ロジスティクスサービスの詳細はこちらをご覧ください。

Our sterile fill-finish global site locations
Our 642,000 sq. ft. campus in Monza, Italy is a center of excellence for sterile manufacturing. It features a unique co-location of mRNA manufacturing capabilities with LNP and fill-finish services to help streamline your processes and mitigate risks.
Our Greenville, NC facility is a large, multipurpose pharmaceutical manufacturing and packaging campus. This site provides both solid dose form manufacturing and packaging and sterile dose manufacturing, filling, and lyophilization of both biopharmaceuticals and small molecules.
Our Ferentino facility is 14,034 sq. m. (151,061 sq. ft.), specializing in integrated sterile liquid and lyophilized product development and commercial manufacturing, including high-potency products and LVP.
Our Swindon facility specializes in integrated sterile liquid and lyophilized product development and commercial manufacturing, including high-potency products and LVP. It offers extensive development and commercial capabilities for sterile dosage forms, including liquid vials, commercial fill-finish lines, and primary and secondary packaging vials.
Our state-of-the-art sterile drug development and manufacturing facility in Singapore supports rapid fill-finish vaccines and other therapeutics for an expanding biopharma market.
Helpful resources

