ウイルスベクター開発・製造サービス
20年以上にわたって培ったウイルスベクター製品の開発・製造経験
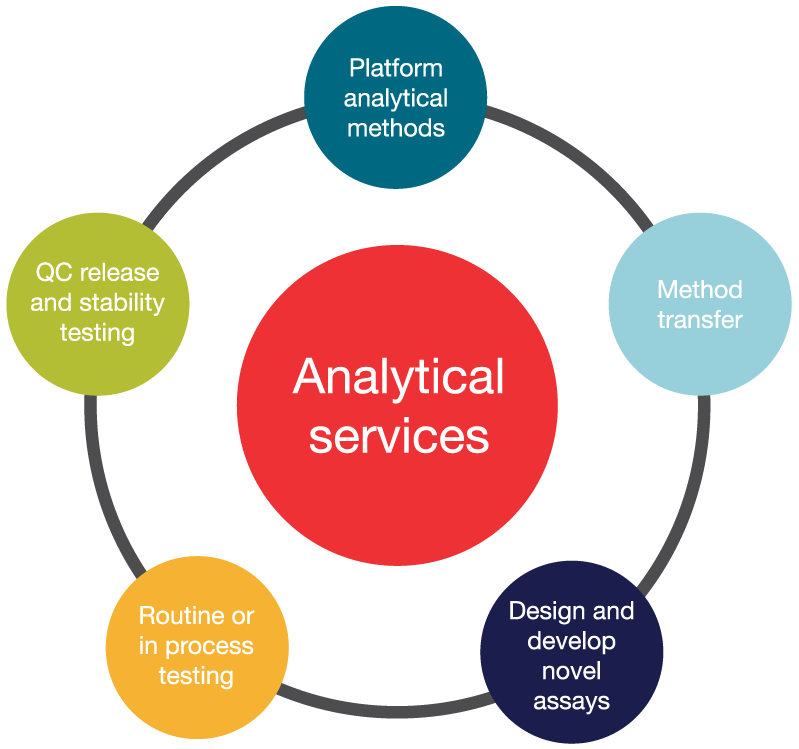
ウイルスベクターの製造は複雑なプロセスを伴います。製品ライフサイクル全体で、製造システムの選択、製品品質の最適化、頑健なCMCアプローチ構築のための手法・手順の標準化など、多くの課題に取り組む必要があります。サーモフィッシャーサイエンティフィックのウイルスベクターサービスは、ウイルスベクターおよび遺伝子治療ベースのワクチンの開発・上市を支援する総合的なCDMOサービスを提供します。プロセス・分析法開発、治験用・商用製造、注射剤・無菌充填(Fill Finish)など、エンド・ツー・エンドのサービスを整備し、世界各地の製造拠点やグローバル治験サプライチェーン、技術面・規制面の専門知識を結ぶネットワークを駆使して、リスクの排除と上市の迅速化に貢献します。
ウイルスベクターにおける経験:
20年以上
開発・製造の豊富な経験
販売承認取得:
2品目
その他複数品目を申請中
製造ロット数:
700ロット以上
北米・欧州でウイルスベクターのGMP治験用ロットおよび商用/プロセス性能適格性評価(PPQ)用ロットを700ロット以上製造
原薬製造スイート:
50スイート以上
製剤製造スイート:12スイート以上
初期発見から商業生産に至るまでの道のりを設計するための専門知識と経験
コアなウイルスベクター製造サービスに加えて、薬の開発と製造の旅のあらゆる側面をサポートする上流および下流の提供も行っています。小規模プロセスを最適化するための初期のトランスレーショナルサービスから、最終製品の安全な保管と配布を容易にするためのコールドチェーンロジスティクスに至るまで、独自の遺伝子療法および遺伝子改変細胞療法プロジェクトを管理するためのエンドツーエンドのソリューションを提供します。

ウイルスベクターの種類とプラットフォーム
cGMPウイルスベクターのプロセス開発における高い専門知識を駆使し、お客様の製品、適応症、送達経路に適した浮遊細胞・接着細胞培養プロセスを構築いたします。プロセスの開発・最適化・スケールアップ、技術移管、さまざまなスケールでのGMP製造における深い経験を蓄積し、遺伝子治療、細胞治療、ワクチン、腫瘍溶解性ウイルス、非ウイルスベクター、免疫療法などの先進治療において700以上のcGMPバッチを円滑に製造いたしました
ベクター製造プラットフォーム・プロセス
| アデノウイルス | アデノ随伴ウイルス(AAV) | |||||
|---|---|---|---|---|---|---|
| 接着細胞培養+浮遊培養細胞 | 産生細胞株+Adv | 接着細胞培養+浮遊培養細胞 | 接着細胞培養+浮遊培養細胞 | |||
| 哺乳類細胞への感染 | 哺乳類細胞への感染 | 哺乳類細胞への一過性トランスフェクション | 昆虫細胞への感染 |
| レンチウイルス(LV) | レトロウイルス(RV) | ヘルペスウイルス(HSV) | |||
|---|---|---|---|---|---|
| 接着細胞培養+浮遊培養細胞 | 接着細胞培養+浮遊培養細胞 | 接着細胞培養+浮遊培養細胞 | |||
| 哺乳類細胞への一過性トランスフェクション | 哺乳類細胞への一過性トランスフェクション | 哺乳類細胞への感染 |
| 改変ワクシニアアンカラ(MVA) | 水疱性口内炎ウイルス(VSV) | ||
|---|---|---|---|
| 浮遊細胞培養 | 接着細胞培養 | ||
| 感染+鳥類細胞株 | 感染+哺乳類細胞、一過性 |
| ウイルス様粒子(VLP) | |
|---|---|
| 浮遊細胞培養 | |
| 昆虫細胞+哺乳類細胞への感染 |
その他のウイルスプラットフォームについても豊富なサポート経験があります。その他の技術力・生産能力についてはお気軽にお問い合せください。
創製から上市までをカバーするウイルスベクターCDMOサービス
プロセスの開発・特性解析から製造、品質管理(QC)、充填(Fill Finish)まで、VVSが誇る幅広い技術力と専門知識により、ウイルスベクター製品の開発・製造を支援いたします。
20年以上にわたるウイルスベクター製品の製造経験をもとに、培養・精製プロセスの開発・最適化・スケールアップ戦略やラージスケールでのパイロット製造基準を確立しています。製品ライフサイクルを通して、各マイルストーンのチェックポイントを確実にクリアし、あらゆる品質基準の遵守を確保します。
- 培養プロセス:浮遊細胞・接着細胞モダリティ、哺乳類細胞・昆虫細胞を用いた培養、実験計画法、スケールアップ
- 精製プロセス:クロマトグラフィを用いた精製、最適化による収率/回収率の向上、完全カプシドの分離、特異的な純度要件
- 試験法開発、分析法の確立・カスタマイゼーション・開発、基盤試験法、プロセス開発試験サポート、前臨床用原薬試験
ウイルスベクターに特化した施設において、世界各地で使用される治験用・商用ウイルスベクターのcGMP製造を行っています。さまざまな製造方法・技術[セルファクトリー、iCELLis、シングルユースバイオリアクター(SUB)など]に対応できる原薬製造スイートを50スイート備えるとともに、半自動・全自動充填ラインと適格性評価済みのさまざまなバイアル・容器施栓系を使用した総合的な無菌充填(Fill Finish)サービスを整備しています。また、グローバル技術移管戦略により、お客様の施設あるいは社内の開発・パイロットラボからの技術移管を円滑に進めることが可能です。各拠点では、承認またはバリデート済みの試験法を用いた工程内試験、出荷判定試験、安定性試験による品質管理(QC)サービスをご利用いただけます。
|
|
|
(QC) |
|
| スケールダウンモデルの適格性評価 | 製造支援研究 | 浮遊細胞・接着細胞培養モダリティ | 公定書収載試験法の検証、試験法の適格性評価・バリデーション | 製剤評価 |
| 実験計画法(DoE) | プロセスバリデーション計画・戦略 | 治験用・商用スケールの生産能力 | 原薬・製剤の工程内試験、バッチ出荷判定試験 | 半自動・全自動充填ライン(Bausch+Strobel、Optima) |
| 重要原材料の有効期間/ロット変動試験 | 故障モード影響解析(FMEA) | 幅広い技術と設備 | cGMP安定性試験 | 適格性評価済みのバイアル仕様 |
| 混合試験 | バリデーション支援研究 | セル/ウイルスバンク作製 | 標準品の適格性評価 | 一次バイアルのラベリング・包装 |
| 重要品質特性(CQA)解析 | 技術移管 | プロセス性能適格性評価(PPQ) | 試験法のブリッジング試験、製品の同等性/同質性試験 | バイアル充填能力:最大10,000バイアル/ロット |
| リスクアセスメント | 技術移管やスケールアップのためのエンジニアリング検討 | |||
| 重要工程パラメータ(CPP)主要工程パラメータ(KPP) | 製造バッチ:最大2,000 L | |||
| 管理戦略 |
先進医療の規制環境は進化し続けており、現在妥当であっても明日には不適切なものとなっている可能性があります。15年以上にわたって、世界各国(米国、EU、カナダ)の規制当局との交渉、CMCに関する規制・ガイドライン・査察を支援してきた経験を誇る規制対応チームが、文書レビューやギャップ分析のほか、申請資料の作成サービスも提供し、仲介業者数とリードタイムの削減を実現いたします。
- CMC資料の作成
- ギャップ分析、CMC資料レビュー
- CMC規制対応戦略のコンサルティング
- 規制当局との面談、申請、査察サポート
- 変化し続ける規制ガイドラインへの的確な対応
De-risk your therapy development and advance to the clinic more quickly
Patheon Quick to Clinic™️ viral vector services
You’ve worked through your options and weighed the advantages and challenges of different expression systems. If you want to get your therapy to market faster and reduce complexities along the way, Patheon’s Quick to Clinic™️ viral vector services is a high-performance, scalable, end-to-end manufacturing program for adeno-associated viral (AAV) and lentiviral (LV) vectors. This program enables you to deliver your gene therapy to the clinic by de-risking timelines and global regulatory filings without any additional or surprising out-of-pocket costs.
Learn more
Start conducting your toxicology studies in as little as six months
Direct-to-toxicology viral vector services
Toxicology studies are crucial for supporting pre-IND regulatory requirements and evaluating the risk-benefit ratio of drug candidates. However, acquiring high-quality toxicology materials can often stretch timelines, and the incompatibility between toxicology materials generation processes and current good manufacturing practice regulations can impede smooth transitions. Our direct-to-toxicology viral vector services program expedites the route to toxicology materials through our adeno-associated virus (AAV) and lentivirus (LV) production processes, completing them in as little as six months.
Learn more
Our viral vector manufacturing sites
A global footprint of over 555,000 square feet is available to develop and manufacture viral vector products. We can find suitable capacity, talent, and technology to ensure a robust product and efficient production processes at multiple sites. We are leveraging the viral vector knowledge and experience from Brammer Bio and Henogen S.A., as well as clinical trial capabilities from Fisher Clinical Services.
State-of-the-art Plainville site (290,000 ft2) designed for end-to-end viral vector services, from process development to commercial manufacturing, with unparalleled capacity and capabilities to meet market demands.
The Seneffe site (34,000 ft2) supports both clinical and commercial manufacturing. This site has over 20 years experience in virus and viral vector manufacturing and has been previously approved by EMA for commercial vaccine production.
Our Cambridge facility (140,000 square feet) performs process characterization, process validation, late-phase, and commercial manufacturing. This site has been manufacturing viral vectors since 2018 and received its first commercial license in Q1/2021.
The Gosselies site (8,300 ft2) specializes in process development, analytical development, early-phase clinical manufacturing, and process characterization for process validation.
Helpful Resources

Blog
Viral vector commercialization – Part 1: Tech transfer process for commercial viral vector manufacturing
Learn how tech transfers can help develop and manufacture viral vectors at scale, accelerate vaccine and gene therapy commercialization, and provide expertise.

Blog
Viral vector commercialization – Part 2: Best practices in process validation lifecycle
Learn more about the robust viral vector process validation cycle, which includes various assessments and studies to ensure the safety, efficacy, and quality of viral vectors.

Article
Strategies to accelerate drug development through harmonization of early and late stage processes
This technical article presents a harmonized and streamlined approach established at Thermo Fisher Scientific for manufacturing AAV and LV vectors for discovery research using technologies and processes mirroring current GMP platforms.
View Article
Webinar
Preparing viral vector productions for commercialization
Gene therapy vectors are rapidly approaching the commercial space so commercial readiness is critical for success. Watch our webinar to learn about our capabilities and approaches for preparing viral vectors for commercialization.
View Webinar
Inforgraphic
Regulatory pathways for CGT and ATMP products
CGT is one of the world's fastest-growing therapeutic areas today. Instead of treating patients for the rest of their lives, these therapies offer them hope of a cure. In this infographic, we will review three tips for achieving regulatory success.
View Infographic
eBook
Cell and gene therapies in the US vs. the EU: Top five areas of differentiation
In this eBook we share the five key differences in the drug development and review process for companies hoping to gain market access through US Food and Drug Administration (FDA) or European Medicines Agency (EMA) approval—as well as tips for navigating these differences.

Fact Sheet
Viral vector development and manufacturing services
Thermo Fisher Scientific provides over 20 years of unparalleled experience in developing and manufacturing viral vector products. We specialize in addressing the complexities of viral vector production for cell and gene therapies, including challenges related to production system selection, product quality optimization, and standardization for a robust CMC approach.

Blog
Viral vector commercialization – Part 1: Tech transfer process for commercial viral vector manufacturing
Learn how tech transfers can help develop and manufacture viral vectors at scale, accelerate vaccine and gene therapy commercialization, and provide expertise.

Blog
Viral vector commercialization – Part 2: Best practices in process validation lifecycle
Learn more about the robust viral vector process validation cycle, which includes various assessments and studies to ensure the safety, efficacy, and quality of viral vectors.
Webinar
Benefits of an integrated approach to gene therapy development and manufacturing
Learn about the development and commercialization of viral vectors for gene therapy, so you can navigate these hurdles and deliver the project in a timely, cost-effective manner.
View Webinar
Article
Strategies to accelerate drug development through harmonization of early and late stage processes
This technical article presents a harmonized and streamlined approach established at Thermo Fisher Scientific for manufacturing AAV and LV vectors for discovery research using technologies and processes mirroring current GMP platforms.
View Article
Webinar
Preparing viral vector productions for commercialization
Gene therapy vectors are rapidly approaching the commercial space so commercial readiness is critical for success. Watch our webinar to learn about our capabilities and approaches for preparing viral vectors for commercialization.
View Webinar
Infographic
Regulatory pathways for CGT and ATMP products
CGT is one of the world's fastest-growing therapeutic areas today. Instead of treating patients for the rest of their lives, these therapies offer them hope of a cure. In this infographic, we will review three tips for achieving regulatory success.
View Infographic
eBook
Cell and gene therapies in the US vs. the EU: Top five areas of differentiation
In this eBook we share the five key differences in the drug development and review process for companies hoping to gain market access through US Food and Drug Administration (FDA) or European Medicines Agency (EMA) approval—as well as tips for navigating these differences.