mRNA医薬品開発成功のためのCDMOの選び方: CDMOに求められる5つの要素
カテゴリー | 先進治療
COVID-19パンデミック下において記録的なスピードでワクチンが開発・上市されたことから、mRNA技術が持つ大きな可能性が明らかとなりました。今回のパンデミック時に医薬品受託製造開発機関(CDMO)が重要な役割を果たしたことは、今後長期間にわたって製薬企業各社との関係に影響を及ぼすでしょう。パンデミック下でmRNAワクチンの開発・製造、そしてサプライチェーン・ロジスティクスの経験を積んだCDMOは、製薬企業パートナーに独自のメリットを提供することが可能です。DMOは今回のパンデミックで得た教訓から、医薬品を開発し、患者さんに届けるという製薬企業各社の取り組みに対する最良の支援の仕方を学びました。
COVID-19のエンデミックへの移行に伴い必要とされるもの
パンデミック下ではCOVID-19ワクチン・治療薬の開発・製造が全世界で展開されたことから、CDMOのサービスに対する需要は急激に増加し、製薬企業各社との提携のあり方も進化しました。今後、パンデミック後の世界において最も有益な製薬企業とCDMOの提携には、次の5つの要素が必要であると考えられます。
- 戦略的パートナーシップ: CDMOが持つ専門知識・技術と資源を最大限に活用し、製薬企業各社が対処しなければならないサプライチェーンおよび製造リスクを深く理解することにより、これらのギャップを埋めることができる差別化技術を構築することが可能です。その結果、パートナーシップモデルはさらに進化し、CDMOがより中心的な役割を担う新たな機会が生まれるでしょう。
- 監査により検証された高い品質基準、 スピードを優先するために品質を犠牲にすることは決してしない姿勢、妥協のない最高水準の品質へのこだわり、COVID-19ワクチンの製造実績を備えたCDMOは、製薬企業パートナーにビジネスアジリティを提供することが可能です。
- 需給変動への供給対応力: 需給変動への対応力を持つCDMOは、継続的に付加価値を提供し、市場の変化に柔軟に対応することが可能です。パンデミック前の製薬企業とCDMOの関係は多くの場合、取引におけるものでした。製薬企業各社は、生産能力の増強や新たな技術が必要な場合にCDMOと提携し、主に出来高払いやプロジェクト単位の委託契約によりサービスを受けていましたが、パンデミックによりこのような事業モデルは大きく変わりしました。
- 現地供給: パンデミック下では政府や非政府組織(NGO)がCOVID-19ワクチン・治療薬の開発・製造を支援するため、資金提供を行いました。今後CDMOは、自社の技術力、そして顧客の脆弱な部分を詳細に把握する必要があります。すなわち、起こりうるサプライチェーンの混乱や地政学的検討事項、市場競争を考慮したうえで生産能力・技術ニーズを評価しなければなりません。また、CDMOは、長期的な視野で生産能力計画を立てる必要があります。
- 幅広いサービス: 総合的なサービス(原料の供給から最終流通までなど)によりmRNAワクチン開発を円滑に進められるCDMOは、科学、製造、ロジスティクスに関する専門知識・技術を社内に備え、厳密なプロセス管理、緊密に連携する施設ネットワーク、高いレベルの品質管理による信頼性を製薬企業パートナーに提供することが可能です。
パンデミック下での課題解決
mRNAワクチンを実験室から臨床まで進めるには、複雑かつ変化し続けるさまざまな課題に対する独自のソリューションが必要となりました。パンデミック下では一刻も早い開発が求められた結果、ワクチンの製剤化、開発計画、サプライチェーン・ロジスティクスにかつてない迅速なイノベーションが生まれました。深い専門知識・技術とすぐに利用できる生産能力が必要とされたことから、実績あるサプライヤーネットワークと確立された施設により、迅速かつ円滑なスケールアップを実現しなければなりませんでした。
製薬企業各社は、mRNA製造技術、ヌクレオチドや酵素の原料供給、セルバンク作製、プラスミド製造、in vitro転写によるmRNA合成、脂質ナノ粒子封入、無菌充填(Fill Finish)、包装、輸送などエンド・ツー・エンドのサポートを提供できる戦略的CDMOパートナーと提携することにより、イノベーションを生み出すことができました。総合的なソリューションを提供できるCDMOは、科学、製造、ロジスティクスに関する専門知識・技術を社内に備え、厳密なプロセス管理、緊密に連携する施設ネットワーク、高いレベルの品質管理による信頼性を製薬企業パートナーに提供することができたのです。
mRNAワクチン成功を導くキーポイント
mRNAワクチンの開発・供給を成功させるには、製薬企業各社は以下の要素を備えたCDMOパートナーと提携しなければなりません。
- mRNAワクチン開発に特有の特性を理解していること
- 臨床ニーズの変化に対応できるよう、製造技術の柔軟性を重視していること
- ワクチンのグローバルサプライチェーンに関するノウハウを備え、供給を確保できること
- 新しい技術を取り入れ、将来の次のステップとしてデジタル化に対応できること
- mRNAの開発・供給の各段階をシームレスに進めることができる総合的なソリューションを把握していること
A critical challenge for raw materials is the need for safety and purity based on regulatory guidelines for products for human use. Raw materials must be free of substances of animal origin, and of beta lactam antibiotics, to eliminate risks of transmissible diseases or viral agents, and risks of allergic reactions and other side effects. Raw material purity is ensured through bioburden and endotoxin testing—and through use of controlled environment, mature quality systems, and extensive quality control testing.
Overall project success depends on selecting the proper quality grade of reagents, identifying appropriate tests to monitor the quality of each intermediate, and selecting the most appropriate formulation, which may include lipid nanoparticle manufacturing. This ensures the lot-to-lot consistency required by industry and global regulatory authorities alike.
To meet this challenge, Thermo Fisher Scientific launched its TheraPure and TheraPure Plus solutions for mRNA production. These are designed to accelerate mRNA vaccine and therapeutics production from preclinical development to commercialization with a portfolio of restriction enzymes, in vitro transcription enzymes, nucleotides, and capping solutions to meet critical process, scale, quality, and regulatory needs. These raw materials are crafted in facilities with thoroughly documented quality systems that are audited by accredited registrars and are manufactured following GMP principles.
Over the past year, the lack of a mature supply chain for mRNA has posed challenges for vaccine production, with the industry moving from manufacturing thousands to billions of doses—a scale-up that would stress any system. Key vendors are working diligently with suppliers to create and scale up manufacture of raw materials such as lipids, enzymes, and resins for purification. Supply is currently a challenge for any vaccine modality, including for simple components such as tubing or filters.
Thermo Fisher Scientific is supporting customers in this space by rapidly expanding capacity for resin production, adding capacity to an existing facility and accelerating build-out of a new facility to double overall production. In 2020, we built a new facility in Vilnius, Lithuania, for industrial-scale single use technology manufacturing. We have manufacturing redundancies in several U.S. locations for reagents used in mRNA synthesis, with the goal of ensuring a stable supply that is accessible from multiple sites on different continents.
An additional challenge is the need for a skilled workforce. Each vaccine is developed, produced, and tested by highly technically skilled people. It has been challenging to find enough people to support the rapid build out in manufacturing, analytics, manufacturing science and technology (MST), tech transfer and chemistry, and manufacturing and controls (CMC). Partnerships with pharma companies should comprise cross-functional teams including raw material developers, process equipment suppliers, analytical experts, formulation scientists, clinical study leaders, and quality compliance advisors.
Capacity has been the primary hurdle for DNA and plasmid production, which mainly uses fermentation, typically with E. coli. Suite dedication is a particular issue, since carrying out a fermentation process in a suite that also runs a mammalian cell culture would lead to a risk of cross contamination. Overall, the plasmid production process is straightforward, starting with fermentation, harvest/lysis/concentration, purification, and formulation. This usually employs a fermenter less than 100 liters in capacity, with relatively small columns of up to 20 liters. For customers with controlled clean space to implement their own plasmid production, we offer Gibco™ fermentation media, single-use fermenters and POROS™ anion exchange and hydrophobic interaction resins.
mRNAワクチン開発:進化と普及
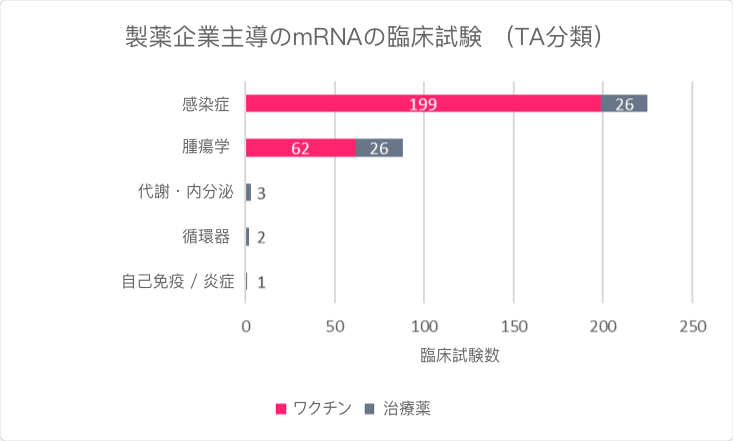
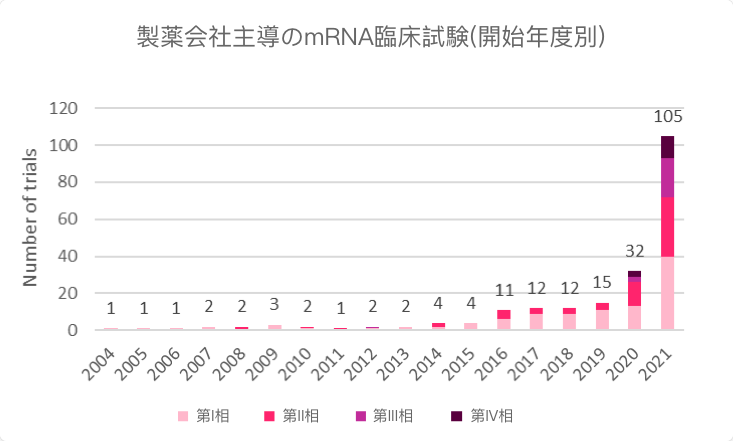
パンデミックが始まって以来、mRNA関連の臨床開発は、感染症ワクチンを中心に急速に展開し、現在200以上の企業主導治験が実施されています(図1および図2)。複数の後期臨床試験が進行中であり、このプラットフォーム技術の理解が進んでいます。しかし、何億回もの投与が行われたにもかかわらず、mRNA技術はまだ初期段階にあり、計218の候補化合物のうち75%(164個)はまだ非臨床段階にあります。SARS-CoV-2に対するmRNA技術の臨床経験とバリデーションのほぼすべてが、モデルナ社とビオンテック社が創製したワクチン2剤によるものです。現在臨床段階にあるmRNAプロジェクトは主に感染症と癌を対象としており、治療薬よりもワクチンに重点が置かれています。
図1:現在実施中のmRNA医薬品の企業主導治験(治療領域別)
出典:Trialtrove(2022年5月)
図2:mRNA医薬品の企業主導治験(開始年別)
出典:Trialtrove(2022年5月)
現在行われているmRNAプラットフォーム開発活動が示すとおり、第一世代製品は期待を上回る成果を収めました。mRNAプラットフォームは、従来型技術に比べ、パンデミック時の対応力、開発のスピード・成功率の高さ、競争力のある臨床プロファイル、優れた製造スケールアップ性、抗原配列の急速な変化への適応力において明らかに優っていたのです。
mRNAをベースとする開発の加速化には共同作業が必要であり、2013年に遡るR&D提携が技術開発を推進させました。COVID-19に関連する技術進歩がきっかけとなって、共同R&D活動が盛んとなり、幅広い提携が最近の製造・販売パートナーシップにつながっています。このような投資は、将来、非パンデミック時の機会創出や次世代プラットフォームの改良にとって有益なレガシーとなるでしょう。
このような提携活動を推進する重要な要素の1つがワクチン・治療薬候補が持つ商業的可能性であることは明らかです。かつてない莫大な収益が長期的なプラットフォーム技術への投資を後押しし、COVID-19ワクチンは史上最高の利益をあげる製品の1つとなると予想されています。各国政府は、初期ワクチン接種プログラムおよびエンデミック期のブースター接種を実施するうえでmRNA技術が望ましいとの見解を示しており、このような販売機会は今後も持続するでしょう。
今後の開発活動により競争力の問題が克服され、非パンデミック下での競争力が高まる可能性があります。例えば、多価次世代ワクチン、凍結乾燥製剤による耐熱性の向上、自己増幅型mRNAによる有効用量やブースター接種の削減、COVID-19後の余剰製造設備などが挙げられます。
今後も大きな可能性を持つこの技術は、パンデミック下のワクチン開発の成功を土台とし、さまざまな新たな機会を生み出すでしょう。mRNAプラットフォームとその製造技術の進歩には数多くのパートナーシップが必要でした。その結果、mRNAが持つ大きな商業的可能性が引き出され、記録的な収益をあげることが可能となりました。このような投資は、将来、非パンデミック時の機会創出や次世代プラットフォームの改良に有益なレガシーとなるでしょう。mRNA技術は、COVID-19以外にも次のような領域で期待されています。
今後も大きな可能性を持つこの技術は、パンデミック下のワクチン開発の成功を土台とし、さまざまな新たな機会を生み出すでしょう。mRNAプラットフォームとその製造技術の進歩には数多くのパートナーシップが必要でした。その結果、mRNAが持つ大きな商業的可能性が引き出され、記録的な収益をあげることが可能となりました。このような投資は、将来、非パンデミック時の機会創出や次世代プラットフォームの改良に有益なレガシーとなるでしょう。mRNA技術は、COVID-19以外にも次のような領域で期待されています。
- 他の感染症に対するワクチン
- 非ワクチン治療薬
- がんワクチン
パンデミックによる原料不足や輸送の混乱の中で経験を積んだCDMOは、合理化された次世代mRNAワクチン・治療薬の開発・製造を牽引できる力を備えています。
View references