EUと米国の規制:細胞治療と遺伝子治療に何が起こるのか?
カテゴリー | 先進治療

細胞治療・遺伝子治療(CGT)製品の開発者は、臨床試験を経て上市を目指す道のりにおいてさまざまな課題に直面しますが、分類法やガイドライン、規制当局の要求事項が米国とEUで異なっていることも課題の1つです。しかし、増加し続けるCGT製品とその製造プロセスについて規制当局が経験を積むにつれて、規制ガイダンスの大きな違いは解消されていくでしょう。既に、米国、EUはいずれも開発過程全体にわたって同様の相談の機会と優先審査・承認制度を提供しています。また、原材料に関する要件や、ラボおよび臨床におけるバリデーションに関するガイドライン、ラージスケールの製造に関するガイダンスなどの領域でも、CGT製品の規制調和が進む可能性があります。
ヒント:米国でのバイオ医薬品およびCGT製品の開発において準拠すべき主な法令は、Food, Drug, and Cosmetic Act(連邦食品医薬品化粧品法)(1938年)第505条、Public Health Service Act(公衆衛生法)(1944年)第351条および第361条などです。
1.原材料の調達・試験に関するガイダンスは統一の方向へ。現在、欧州医薬品庁(EMA)および米国食品医薬品局(FDA)は、CGT製品やその他のバイオ医薬品の原料・成分について異なる定義を設定しており、その結果、各物質の起源および規格の文書記録に関する期待事項は異なっていますが、今後、以下のような動向が予想されます。
- 各物質の試験要件は、原料であるのか、原薬であるのかという分類ではなく、製品およびプロセスに対する重要性に基づいて決められるようになる可能性があります。
- 開発段階、製造販売後のいずれにおいても、プロセスおよび製品の一貫性の維持に寄与する品質管理に関する文書記録要件は、より統一されていくと思われます。原料であるか、重要成分であるかにかかわらず、患者さんの体内に入っていく物質について両規制当局が最も関心があるのは、最終製品の安全性と一貫性を確保する品質管理です。
それまでの間は、製品およびプロセスに対する出発物質/原料のリスクについてICH Q9に準拠したリスク・ベネフィット評価を行うことにより、不確実性を低減し、製品の安全性と品質を確保しなければなりません。
ヒント:EUでの先進治療医薬品(ATMP)の開発において準拠すべき主な法令は、ATMP regulation 1394/2007/EC、Directive 2009/120/ECなどです。
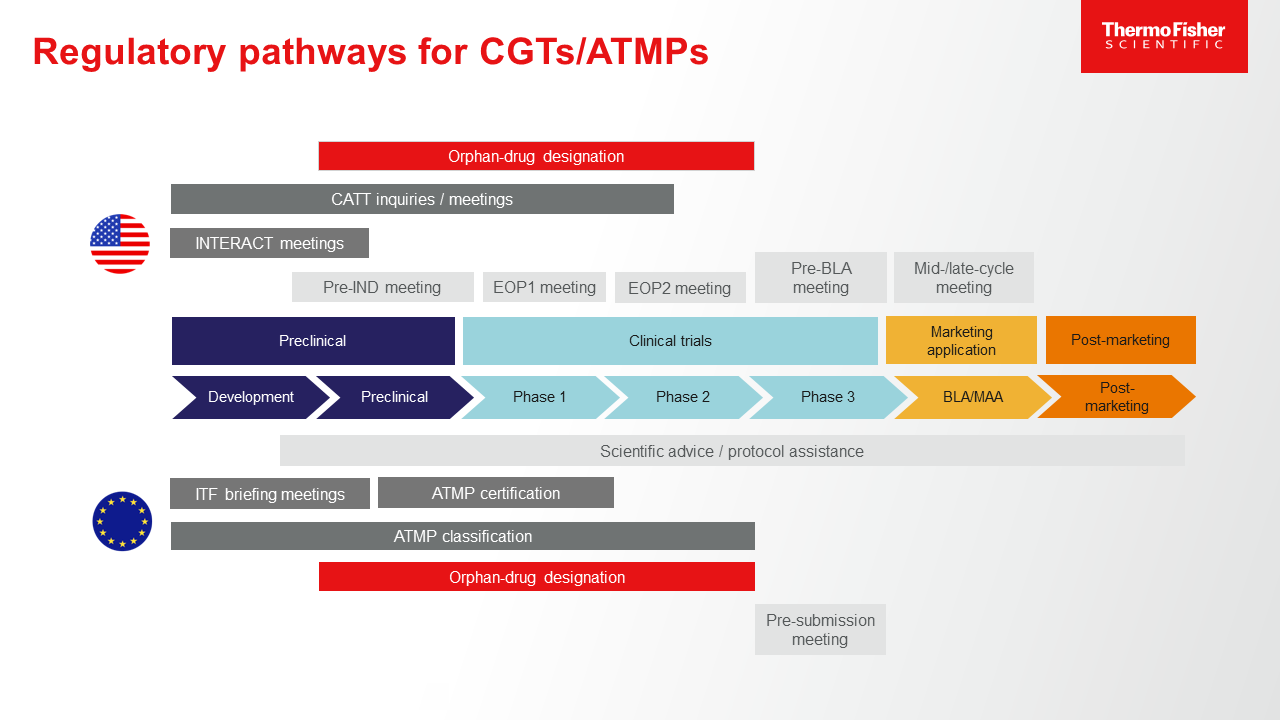 Figure 1- Opportunities for early and ongoing interaction with regulatory bodies during CGT development
Figure 1- Opportunities for early and ongoing interaction with regulatory bodies during CGT development
2.前臨床および臨床でのバリデーション・安全性に関する文書記録については、より厳しい期待事項が示されることが予想されます。CGT製品[EUの法令・ガイダンスでは先進治療医薬品(ATMP)と呼ばれています]の前臨床・臨床研究では、一部の新規治療製品について、安全性や純度、力価、標的作用、毒性の有無、薬物動態/薬力学的反応などを確認する最適な方法が明確ではない場合があることが課題となっています。このため、適切な定量法や評価指標、評価項目、安全性モニタリングのための試験を見極めるプロセスがあいまいであり、少なくとも現時点では、利用可能なあらゆる知識を使って個別に検討・選択されることが多くなっています。薬物送達方法や作用機序、CGT製品の原材料がより一般的になり、それらに関する規制当局の知識・経験が増すにつれて、以下のような動向が予想されます。
- 安全性およびバリデーションに関する最低限の期待事項については統一されるでしょう。これらは、CGT製品のカテゴリーや薬物送達プラットフォームの起源によって異なる可能性がありますが、さまざまなCGT製品について、その分類と文書記録が必要とされる領域の明確化が進むと思われます。
- 今後の製品については、分析法や治験デザインについてガイダンスが示され、シンプル化されるでしょう。これは、希少疾病に対するメディカルニーズを満たす新規CGT製品については迅速開発が適用されることが多いことから、特に役立つと思われます。
それまでの間は、EMAおよびFDAの双方と早期にかつ定期的に相談することにより、分類や分析法、臨床開発、製造に関する問題に対処しやすくなります。
3.製造パラメータについては、より明確な期待事項が示されると予想されます。分類や原材料に関する要件には違いがあるものの、製造パラメータに関する期待事項は全体としてEUと米国で既にかなり一致した内容となっています。したがって、以下の動向を予想することが妥当でしょう。
- 上市されるCGT製品が増えるにつれて、規制当局の審査・承認経験も蓄積され、その結果、継続的な原材料試験や製造パラメータ、プロセス管理、スケールアップ方法、流通に関する期待事項についてより詳細なガイダンスが示されるでしょう。医薬品グレードのCGT製品製造を求める現在の要求事項が緩和されることはないため、適格性が確認され、CGT製品製造能力を備えた医薬品受託製造開発機関(CDMO)との提携はリスク低減の重要な機会となります。CGT製品製造許可を取得した施設での製造が求められますが、このような許可は各施設が専門とする製品タイプに、より特化したものとなる可能性があります。
それまでの間は、既承認CGT製品の製造実績のあるCDMOの支援が特に重要でしょう。過去の製造経験から得られた情報をもとに新しいプロセスの開発を速やかに進めることにより、新規治療薬の製造課題の解決、円滑な申請・承認の確保に貢献できるからです。
以上のとおり、CGT製品の開発・製造に関するガイダンスがより正式なものとなり、統一されることはバイオ医薬品企業にとっても患者さんにとっても有益ですが、継続的なデータ取得と薬事制度の整備が必要であり、それには時間がかかります。今後、幅広いCGT製品とそれぞれの特性に関する規制当局の経験の蓄積に伴って、研究活動の明確化と開発・申請プロセスの効率化のためのガイダンスが地域間でますます統一され、標準化が進むでしょう。非バイオ医薬品開発でみられるように、管轄地域間でいくつかの差異は今後も残ると思われますが、より一貫した期待事項が他の地域のCGT製品規制ガイダンスにも反映されるでしょう。それまでの間は、患者さんの安全を守るという米国およびEUの規制の基本姿勢を理解することが、CGT製品開発企業にとって重要な道しるべとなります。
こちらをクリックし、業界のエキスパートであるMonica CommerfordとClara Ferloniによる最近のウェビナー「細胞治療・遺伝子治療製品の上市のための柔軟な薬事制度とCMC領域のキーポイント」を是非ご覧ください。


