各種資料&最新情報
カタログ・ウェビナー等 / 製造拠点 / イベント情報
サーモフィッシャーサイエンティフィックの各領域エキスパートのほか、医薬品製造・治験業界の技術・科学エキスパートと協力し、各種ホワイトペーパー、報告、ウェビナーなどをご用意しました。分子から医薬品までの開発プロセスの円滑な推進にご活用ください。
メニューボタンを使って検索を絞り込んでください。下のフィルターを使って、カテゴリーや領域エキスパート、内容別にライブラリ全体を検索することもできます。
資料のダウンロードにあたっては、登録フォームへの入力をお願いする場合があります。
質問はございませんか?お問い合わせは、こちらまでお気軽にご連絡ください。
インフォグラフィック
Path to IND for biologics: INDまでの迅速ルート:バイオ医薬品をDNAから製剤化まで最短9ヶ月で実現
Path to IND for biologics が、品質を維持しながらどのように開発期間を短縮できるのかをご確認ください。
当社の CHO K1 細胞株とトランスポザーゼ技術を活用した、タイムラインを圧縮する主要ステップをご紹介します。

ブログ
OSD開発でつまずかないために:初期製剤設計が規制対応を左右する理由
経口固形製剤(OSD)開発における初期の製剤設計の選択は、プログラム全体の行方を大きく左右します。
バイオアベイラビリティや安定性、あるいは規制ドキュメントに関する問題は、往々にして後工程で顕在化し、高コストな遅延を招きます。
製剤戦略を初期段階からスケーラビリティと規制対応に整合させることが、INDからNDAまでを見据えた確実な開発につながります。
10 minute read
臨床から商業化へ:先端治療を支えるコールドチェーン物流の最適化
先端的な細胞・遺伝子治療プロジェクトにおけるコールドチェーン物流を、サーモフィッシャーサイエンティフィックがどのように最適化できるかをご覧ください。

ビデオ
St. Louisにおけるバイオ医薬品製造のためのシングルユース技術
Thermo Fisher Scientificが米国ミズーリ州St. Louisで進めるバイオ医薬品拠点の拡張の全貌をご紹介します。
本施設は、シングルユース技術を活用したCDMOとして全米最大規模となり、次世代バイオ医薬品の開発・製造を力強く支える新たな中核拠点へと進化しています。是非ビデオで御覧ください。

ブログ
初期ステージのバイオベンチャーが知っておくべき、外注戦略の成功と失敗の分岐点
本ブログでは、創薬初期段階における意思決定が開発プログラム全体に与える影響に焦点を当て、アウトソーシング戦略をいかにして競争力のある開発モデルへと進化させるかを解説します。
初期構想から下流工程の実行までを一貫して見据えたアプローチにより、遅延やリスクを最小化し、開発スピードと成功確度を高めるための実践的な視点をご紹介します。
10 minute read

ホワイトペーパー
治験物流を進化させ、開発価値を最大化する
スケーラブルなネットワーク、デジタルツール、そしてプロセスの高度な同期化が、治験サプライをいかに効率化し、グローバル規模での信頼性とスピードを強化するのか。その具体的なアプローチを、ぜひご確認ください。

ファクトシート
製剤開発における課題を解決するソリューション
溶解性の低いAPIのバイオアベイラビリティ向上という製剤開発上の課題に対し、スプレードライ技術は有効な解決策を提供します。当社は、豊富なプロセス開発実績と専門知識を基盤に、分子特性に即した最適な製剤設計を実現します。是非こちらの資料をご覧ください。

パンフレット
バイオ医薬品の成功を支える、後期開発から商業生産までの確かなスケールアップ
サーモフィッシャーが、後期開発段階から商業供給に至るまで、バイオ医薬品プログラムのスケールアップをどのように成功へ導いてきたのか。4つの実践的なケーススタディを通じてご紹介します。

Blog post
CDMO/CROの統合で実現する、医薬品開発のスピードアップ
研究開発費の高騰や開発期間の長期化など、医薬品開発を取り巻く環境は年々厳しさを増しています。本ブログでは、原薬・製剤開発から治験薬製造、臨床試験、治験薬サプライチェーン管理までを統合的に支援するCDMO/CROアプローチに着目し、開発の複雑化をいかに解消し、効率化とリスク低減を実現できるのかを分かりやすく解説します。研究から上市までのスピードを高めるためのヒントを、ぜひご覧ください。
12 minute read

インフォグラフィック
医薬品開発に特化した中核拠点:ベンドが支える処方開発力
米国、ベンド拠点は、溶解性改善、先進的ドラッグデリバリー、初期開発におけるセンター・オブ・エクセレンスです。
こちらの資料をダウンロードし、数値で裏付けられた当拠点の開発実績と実力をご確認ください。

ブログ
アンシラリーサプライ管理から考える治験の規制対応
アンシラリー管理において直面する規制上の課題と、リスクを最小化し、変化する要件へ最適に適応するためのアプローチについて、専門家の視点から解説します。
15 minute read

Event
Tradeshow
DCAT Week 2026
Meet with us at DCAT to learn how our connected CDMO, CRO, and clinical supply services support sponsors at every stage of the drug development journey.

Event
Conference
ISCR 19th Annual Conference
Visit our booth at the ISCR 19th Annual Conference in New Delhi and explore how our comprehensive, global clinical trial services and solutions can help support the success of your next study.

ブログ
経口固形製剤(OSD)開発において、後期開発を成功に導くための実践的アプローチ
データに基づいた開発戦略とリスク管理、そして信頼できるCDMOとの連携により、経口固形製剤(OSD)の後期開発スケールアップを、無理なく確実に成功へ導く方法を分かりやすく解説します。
11 minute read

医薬品開発の価値を再定義する――成功を加速させる新しい開発モデル
従来型のアウトソーシング戦略では、今日の医薬品開発が求めるスピードや複雑性に対応しきれなくなっています。本ホワイトペーパーでは、インフラ、専門性、ガバナンスを統合することで、リスク低減とオペレーションの効率化を実現し、現代の医薬品開発における「成功」のあり方を再定義する、より連携された開発モデルの有効性を分かりやすく解説します。

Infographic
オートインジェクター、ペン型デバイス、プレフィルドシリンジに対応する開発・製造能力
インタラクティブなインフォグラフィックを通じて、オートインジェクター、ペン型デバイス、プレフィルドシリンジに対応した当社の柔軟なケイパビリティが、生物学的製剤の開発から供給までをどのようにスムーズにし、開発スピード向上に貢献するのかを分かりやすくご紹介します。

ウェビナー
自信をもって加速する: CDMO–CROパートナーシップの意思決定を導く、研究に基づくインサイト
本ウェビナーでは、CDMO、CRO、治験薬供給機能を統合したパートナーと連携することで得られる財務的リターンとリスク調整後価値を定量的に示した、タフツの最新研究のエッセンスをわかりやすく解説します。戦略的なアウトソーシングが、いかに開発スピードと価値最大化を実現するのか、その実像に迫ります。

ウェビナー
賢いスケールアップが、成功を決める: スケールアップの課題を、戦略で超える
統合されたグローバルCDMOモデルが、バイオ医薬品の臨床・商業製造における最大の課題をいかに乗り越えるのか。本オンデマンドウェビナーで詳しく解説します。

ブログ
バイオ医薬品製造のスケールアップにおける真のボトルネックは、製造能力ではなく需要予測にある
多くのバイオ医薬品は、大規模なステンレス設備を必要とするほどの生産量には至りません。
本当に難しいのは、設備を十分に用意することではなく、「いつ」「どれだけ」必要になるのかを正しく見極めることです。
そのため今、注目されているのがスケールの柔軟性です。
需要の変化に合わせて調整できる製造戦略こそが、バイオ医薬品製造における新たな競争力になりつつあります。
その理由を、これから詳しくご紹介します。
16 minute read

ホワイトペーパー
従来型のOSD開発から、先を読む開発へ
技術力、グローバルネットワーク、カスタマイズされたサービス、そして規制対応の専門性がどのように連携し、経口医薬品開発における課題を克服していくのかを解説します。

Event
Tradeshow
Clinical Trial Supply Europe 2026
Connect with our experts at CTS and discover how our integrated CDMO and CRO offerings and our strategic clinical supply services can support your trial needs.

ウェビナー
AI × 実験データで変わる製剤開発:モデルから分子設計までを加速する新戦略
本オンデマンドウェビナーでは、計算科学(AI・予測モデリング)と実験データのアプローチを組み合わせることで、製剤開発における課題をどのように解決できるのかを、実際のケーススタディを交えて解説します。

ケーススタディ
Accelerator ™ Drug Development: 統合型マネジメントでグローバル治験を効率化
本ケーススタディでは、あるバイオ医薬企業がAccelerator™ Drug Developmentを活用し、複雑化していた臨床開発プログラムの統制を取り戻し、パイプライン全体で成果を生み出した事例をご紹介します。
Webinar
バイオ医薬開発の加速:最終DNAから第Ⅰ相試験まで、9か月未満での到達
BIO International 2025で発表された本ウェビナーでは、Path to INDプログラムが、バイオテック企業のDNA配列決定後からファースト・イン・ヒューマン(FIH)第Ⅰ相試験開始までを、最短9か月で実現するためのアプローチを解説します。

ケーススタディ
Accelerator™ Drug Development は、前臨床から First-in-Human(FIH)試験への移行を高速化する統合プログラム
ケーススタディをダウンロードして、あるバイオテック企業が Thermo Fisher Scientific の統合型 CDMO/CRO ソリューションを活用し、100万ドルのコスト削減と 12か月の開発期間短縮をどのように実現したかをご覧ください。

Blog post
バイオテックの未来を語る
バイオテック産業を形づくる最新トレンドについて、専門家の視点から探ります。イノベーション、サステナビリティ、AI、そして成長を支えるダイナミックな環境など、多角的なテーマを取り上げます。
10 minute read

Event
Tradeshow
Biotech Outsourcing Strategies (BOS) Manchester 2025
Visit Thermo Fisher Scientific at booth #47 to learn how Accelerator™ Drug Development can streamline and speed up early-phase OSD development for small molecules and biologics.

Event
Tradeshow
Clinical Outsourcing Group (COG) Europe 2025
Let’s connect at COG Europe 2025 in November to discuss how our integrated CDMO and CRO solutions, including clinical trial supply services, can help get your treatments to patients faster.

Event
Conference
Clinical Trial Supply East Coast 2025
Visit booth #50 to explore how our integrated CDMO and CRO solutions, including clinical supply services, can help you get treatments to patients faster.

Event
Conference
AAPS 2025 PharmSci360
Join us at AAPS 2025 to explore the modern technologies we utilize to enhance oral solid dose and small molecule drug development processes.

Event
Conference
AusBiotech International Conference 2025
Visit booth #87 at AusBiotech International Conference 2025 to learn how our end-to-end CDMO services and solutions can help speed up your drug development and manufacturing journey.

Event
Tradeshow
Bioplus-Interphex Korea (BIX) 2025
Discover how Thermo Fisher Scientific supports biopharma innovators at BIX 2025. From early development through commercial manufacturing, partner with us as your trusted CDMO to speed up your path to patients.

Event
Conference
Festival of Biologics Basel 2025
Visit us at Festival of Biologics to learn about our innovative technology powering process development and late-stage biologics production and manufacturing.
Blog post
臨床試験の成功を加速する最新パッケージング&ラベリング戦略を専門家が解説
革新的な臨床試験用パッケージング&ラベリングソリューションが、どのようにプロセスを効率化し、業務の精度とスピードを高め、規制遵守を確実にしながら臨床試験全体の成功につなげるのか――。
専門家によるインサイトを、ぜひ本ブログでご覧ください。
15 minute read

ビデオ
臨床試験のためのTrial Setup and Planning (TSP) ソリューション
このビデオでは、臨床試験の精度と効率を最大化するために設計された当社のTrial Setup and Planning (TSP) システムを紹介しています。このシステムは、明確なプロトコール策定、適切な被験者選定、信頼性の高い方法論を通じて、臨床試験の完全性と結果の信頼性を保証します。詳細はビデオでご確認ください。

Event
Conference
2025 Cell & Gene Meeting on the Mesa
Join us at Meeting on the Mesa to explore how our integrated CDMO and CRO solutions for advanced therapies can support the unique needs of your program.
Accelerator™ Drug Development ― 統合型CDMO & CROサービスの紹介(Pharm Tech Japan 2025年9月掲載記事)
研究開発から製造・治験薬供給までを一貫支援する“360°統合モデル”。
分断型アウトソーシングに比べ、ROIは最大113倍、治験開始を最長12カ月前倒し。50年以上のCDMO実績を誇る総合力で、革新的治療薬をより早く患者様へ届けます。是非,
Pharm Tech Japan (じほう社)の最新記事をご覧ください。

イベント
第50回製剤・創剤セミナー(2025)
来たる2025年9月17日(水)~18日(木)の2日間、会場:東レ(株)東レ総合研修センターにて開催される第50回製剤・創剤セミナーに出展いたします。最新サービスのプレゼンテーションも行います。

バイオ医薬品の細胞株開発における科学的アプローチ:安定性と収率改善
バイオ医薬品製造において、細胞株開発は効率性やスケーラビリティ、製品の安定性を左右する重要なプロセスです。
近年進歩している CHO-K1細胞株エンジニアリング により、より高い生産収率、遺伝子の安定性向上、そしてIND申請までの迅速な道筋が実現可能になっています。
当社の最新アプローチは、研究から臨床開発までを加速し、より信頼性の高いバイオ医薬品製造を支援します。
15 minute read

eBook
グローバルな展開力 × バイオテックのスピード:成果をもたらす臨床試験用包装・ラベリング
本eBookをダウンロードして、バイオテクノロジー分野の包装・ラベリングパートナーに求められる3つの必須条件を確認し、Thermo Fisherの差別化されたソリューションが皆様の臨床試験をどのように支援できるかをご覧ください。

Webinar
アウトソーシングからパートナーシップへ:グローバル臨床試験の新しい価値創造
11件の治験、51か国、1つのチーム。
CDMOを単なる委託先ではなく、価値を生み出すパートナーとして再定義することで、NewAmsterdam Pharmaの小規模チームがいかに驚くべき成果を達成したのかをご紹介します。

eBook
革新的な360˚ CDMO・CROソリューションで医薬品開発を加速: 開発プロセスを効率化し、市場投入までの時間を短縮するための包括的ガイド
本eBookでは、医薬品開発の全フェーズにわたり、リソースの最大活用とリスク低減を実現する実践的ソリューションを紹介しています。各バイオテックや製薬企業が、自社の強みを活かしながら市場投入までの道のりを加速できるよう支援する内容です。

ファクトシート
第I相試験用原薬の速やかな開発・製造を実現するPath to IND for Biologics
IND申請に向け、第I相安全性試験の加速化は優先事項となっています。サーモフィッシャーサイエンティフィックのPath to IND for Biologics は、First-in-Human試験用バイオ原薬をトランスフェクション開始からわずか9ヵ月で開発するプログラムです。

Webinar
成功を実現する戦略で、バイオ医薬品開発を加速
本ウェビナーでは、医薬品開発者が規制要件、臨床試験、生産スケールアップ、品質管理といった課題に対応しながら、いかにして革新的なバイオ医薬品を迅速に提供できるかを探ります。是非ご視聴ください。

Five hidden risks in early-phase OSD formulation development
Early-phase oral solid dose development presents a range of hidden risks that can impact long-term success. From API complexity to scalability and regulatory readiness, thoughtful planning can help mitigate setbacks and keep programs on track.
12 minute read

Event
Tradeshow
Clinical Trial Supply West Coast 2025
Visit booth #15 to explore how our integrated CDMO and CRO solutions, including clinical supply services, can help you get treatments to patients faster.

市場投入までを加速:ROIと効率を両立する医薬品開発
新たな研究により、製造、臨床開発、サプライチェーンを単一のパートナーに統合することが、プロセスを簡素化し、実行スピードを高め、医薬品開発における投資対効果(ROI)を大きく向上させることが実証されました。詳細はこちらのリンクより

Event
Tradeshow
GCSG 2025 European Knowledge Forum
Join Thermo Fisher Scientific at the GCSG 2025 European Knowledge Forum from October 14–16, 2025, to learn more about our integrated clinical supply, CDMO, and CRO solutions.

Optimizing clinical supply management with a one-team approach
Download our case study to explore how our CDMO and CRO services helped NewAmsterdam Pharma deliver investigational medicinal products for over 12,000 patients across 835 clinical sites.

Event
Tradeshow
BIO Taiwan 2025
Connect with us July 23-27 in Taiwan, to explore pharmaceutical supply chain hot topics and discuss how we can accelerate your journey from molecule to medicine to market.

Event
Conference
CRS 2025 Annual Meeting and Exposition
Connect with us at CRS to explore our specialized expertise and full range of controlled release technologies and formulation services.

イベント
BIO 医薬 EXPO 2025 (Interphex Japan)
2025年7月9日~11日に東京ビッグサイトで開催させるInterphex Japan 2025 (BIO医薬EXPO) に出展いたします。 会場にお越しの際は是非弊社ブースにお立ち寄りください。

イベント

イベント
日本プロセス化学会サマーシンポジウム2025
2025年7月24日~25日、タワーホール船堀で開催される日本プロセス化学会サマーシンポジウムに出展しています。
APIに関する最新情報をご紹介いたします。

Understanding large molecule drugs
This blog provides a deep dive into large molecule drugs, or biologics, exploring their key characteristics, advantages and challenges, and future in the pharmaceutical industry.
18 minute read

eBook
Optimizing clinical trial logistics for success
This comprehensive guide discusses the complexities of clinical trial logistics. Learn how Thermo Fisher Scientific’s Total Transportation Management can help ensure timely and secure delivery of clinical trial materials worldwide.
CHO-K1細胞培養プロセスの最適化によるIgGモノクローナル抗体生産性向上
ケーススタディをダウンロードして、当社の科学者がCHO-K1細胞株を活用し、既存の製造プラットフォームと設備を最大限に生かし、品質を損なうことなく、力価を80%向上させた事例をご覧ください。

Webinar
重要な生物資材を守るためのリスク管理と保護戦略
本ウェビナーでは、バイオ医薬品・細胞/遺伝子治療製品の超低温保管・管理の重要性と、適切なCDMOパートナーが製品の完全性をどのように守るかをご紹介します

Webinar
Assessing the application of standardized processes in cell and gene therapy development and manufacturing
This webinar features experts in cell and gene therapy (CGT) development, regulatory affairs, and CMC strategy, offering guidance on assessing the risks and rewards of standardized processes.

溶解性およびバイオアベイラビリティ向上のための予測モデリング
製剤開発における低溶解性・低バイオアベイラビリティの課題と、予測モデリングによる解決の可能性をご紹介します。
候補化合物の特性を開発初期に見極め、適切な製剤戦略を導くための新たなアプローチとして、予測モデリングが注目されています。
是非ご一読ください。
15 minute read
記事
生産の柔軟性が競争優位性をもたらす—5,000Lシングルユースバイオリアクター(SUB)が生み出す新たな価値
パセオンの 5,000Lシングルユースバイオリアクター(SUB) による 柔軟な生産戦略 を解説。スケールアップ/ダウンの迅速化、コスト削減、品質マネジメントの強化により、開発スピード向上を実現します。詳しくは記事をご覧ください。

インフォグラフィック
統合型CDMOおよびCROソリューションで市場投入までの時間を短縮
こちらの資料では、複雑な医薬品開発プロセスにおいて、研究から製造まで一貫したサービスを提供する統合型CRO/CDMOパートナーと連携するメリットをご紹介しています。ぜひご覧ください。

Webinar
ペプチド・タンパク質の経口投与:課題とその突破口
本ウェビナーは、3月12日に開催されたウェビナーのオンデマンド配信です。ペプチド・タンパク質治療薬の経口投与における課題と最新の技術革新について、多角的な視点から解説します。経口ペプチド医薬品の開発を加速するための科学的・実務的知見や規制対応の戦略もご紹介します。

Blog post
コールドチェーン・ロジスティクスの重要な役割:研究室から患者まで、医薬品の品質を守る
本ブログでは、バイオ医薬品業界におけるコールドチェーン・ロジスティクスの重要な役割について解説し、CDMO/CROパートナーが医薬品開発企業とともに、製品の品質と有効性を確保するためにどのように貢献できるのかをご紹介します。
(12 minute read)

Video
Advantages of Softgel Technologies with Tony van Bijleveld
Tony van Bijleveld, Vice President, Sales, discusses the benefits of the recent Thermo Fisher Scientific acquisition, as well as Softgel expertise & technology to enable innovative customer solutions for patients.

Video
Benefits of Working with Patheon Softgels
Kaspar van den Dries, Ph.D. discusses the benefits of working with Patheon for your softgels project.

ブログ
Paul Jorjorian
Vice President and General Manager, Biologics
Scientific Expertise:
- Research and development
- Process and analytical development
- MSAT strategy
- Biologics manufacturing
- Technology transfer
Focus Area
Biologics development
Credentials
Bachelor’s degree in chemical engineering and management, Purdue University
Master’s in chemical engineering, Cornell University
イベント
パセオン主催 技術セミナー2025 :バイオ医薬品・ウイルスベクター開発~グローバルIND・上市準備の成功の鍵~
2025年4月7日(月)、日本橋Link-J(ライフサイエンスビルディング) にて、グローバルCDMOエキスパートによる、バイオ原薬、再生医療等製品の最新動向、CDMOサービスを紹介するセミナーを開催します。

Event
ウェビナー
パセオンウェビナー(OSD)開催のお知らせ
2025年3月12日 10:30より、パセオン ウェビナー を開催いたします。
本ウェビナーでは、ペプチド・タンパク質の経口投与に関する最新の課題と革新的な解決策について、業界の専門家が詳しく解説いたします。

ブログ
持続可能なAPI開発と製造に向けたグリーンケミストリーの活用
API(医薬品有効成分)の初期開発段階は、リスクや課題が伴うものの、環境に優しい製造方法を取り入れるための重要なタイミングです。この取り組みは、廃棄物を減らし、エネルギーや資源の使用を最小限に抑えるなど、環境への負荷を軽減することを目的としています。また、これにより化合物が臨床試験に進む過程で、大規模かつコスト効率の高い製造プロセスを実現するための土台を築くことができます。
9 minute read

ブログ
プロセス開発が重要な理由:バイオテクノロジー企業と製薬企業にとっての6つのメリット
このブログでは、医薬品開発と製造におけるプロセス開発の重要な役割について解説しています。さらに、プロセス開発を優先することでスポンサー企業が得られる6つの主なメリットを紹介します。
15 minute read
ホワイトペーパー
組換えAAV(アデノ随伴ウイルス)製造プラットフォームの現状評価
ウイルスベクターを活用した治療法の可能性を最大限に引き出すためには、組換えアデノ随伴ウイルス(AAV)ベクターのための信頼性の高い製造プラットフォームが必要不可欠です。
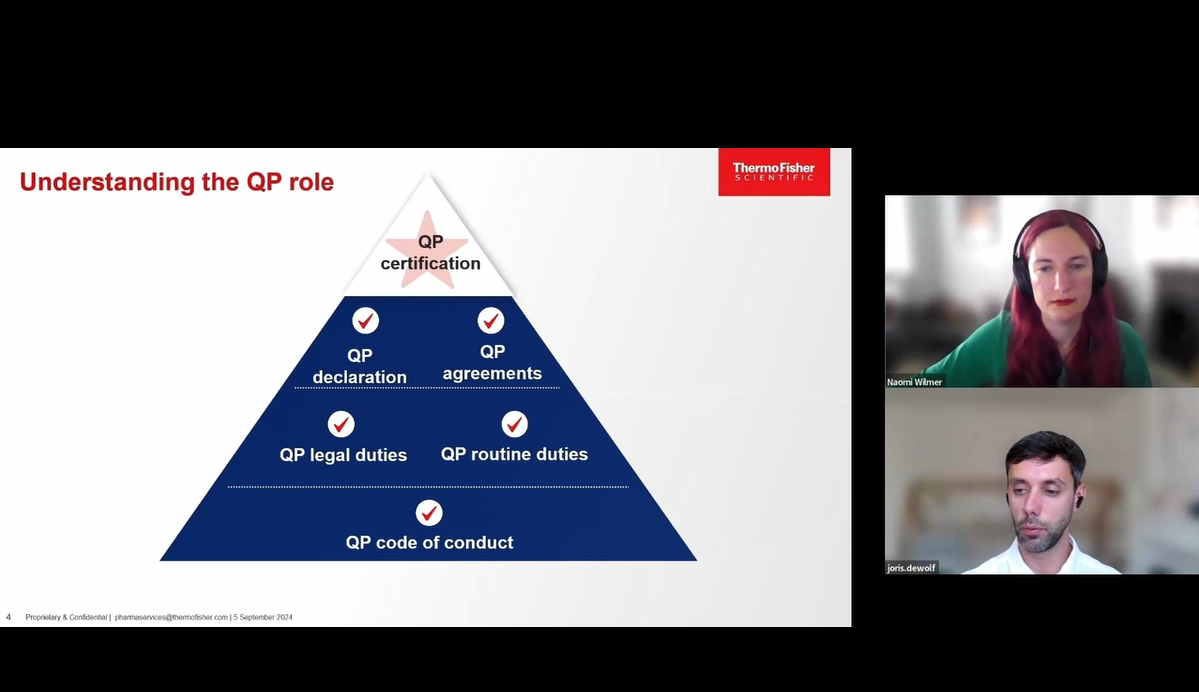
ウェビナー
複雑化するサプライチェーンの課題に対応する:英国およびEU認定資格者(QP)の重要な役割
このウェビナーでは、英国およびEUにおける認定資格者(QP)の役割を探り、最新の規制動向、サプライチェーンの継続性、冷凍製品に関する課題、そして効果的な連携のための戦略について詳しく解説します。

Webinar
ヨーロッパにおける医薬品輸送管理の最適化:サプライチェーンにおけるリスク軽減
こちらのウェビナーでは、温度に敏感な先進医療の臨床試験物流や医薬品輸送管理の複雑性について、特にEMEA(欧州・中東・アフリカ)地域を中心に解説します。詳細をご覧ください。

ブログ
CPHI 2024からの洞察:柔軟な財務ソリューションで細胞・遺伝子治療開発の高コストを乗り越える
細胞・遺伝子治療の開発者は、重要なプロジェクトを停滞させる可能性のある大きな財務的課題に直面しています。柔軟な財務ソリューションは、コスト管理と治療の進展を支援しています。CPHI 2024 Milanでは、Thermo Fisher Scientificのウイルスベクター、mRNA、細胞治療サービス部門のコマーシャル部門のであるバイスプレジデントであるケリー・ハワードが、Thermo Fisher Financial Solutionsを通じて利用可能な柔軟な選択肢について講演しました。
8 minute read
ブログ
低分子医薬品とは何か?その開発、製造、そして可能性についての洞察
低分子医薬品の基本から詳しく解説します。開発や製造における主な課題、そして現代医療における将来の可能性について探ります。
16 minute read

ブログ
医薬品開発プロセスの加速を新たに定義する
製薬業界では、必要な治療法を患者に迅速かつ安全に届けるためには、開発過程全体で遅延や複雑さ、リスクを最小限に抑えることが重要です。Thermo Fisher ScientificのAccelerator™ Drug Developmentは、CDMOおよびCROの360°統合ソリューションを提供し、開発に必要なすべてのサービスを一か所で提供します。この統合サービスにより、製薬企業は治療法を患者に届けるまでの時間を大幅に短縮することが可能になります。
16 minute read

ウェビナー
CDMO + CROの優位性:サプライチェーンの効率化から患者中心のバリューチェーンへ
このウェビナーでは、CDMOのサプライチェーンがどのように患者価値を高める「バリューチェーン」へと進化しているかを探り、製薬業界を前進させる上でCRO/CDMOの連携がますます重要になっていることを議論します。
記事
mRNA製品の複雑な規制環境を乗り越える
この記事では、mRNA製品における複雑な規制環境に対応するためのベストプラクティスを紹介し、CDMOとの提携がどのように安心感を提供するかを解説します。

ウェビナー
柔軟で効率的なRapid Development Framework™を活用した細胞および遺伝子治療の開発と製造の加速
Rapid Development Framework™は、プロセスと分析の分野で開発と製造のスケジュールを効率化し、各製品の個別ニーズに柔軟に対応することが可能です。このフレームワークがどのように医薬品開発を加速するのか、ぜひ学んでください。

5,000Lシングルユースバイオリアクターがもたらすバイオ医薬品製造の新時代
本ホワイトペーパーでは、バイオ医薬品製造における生産能力のニーズを評価する方法や、各開発段階でシングルユースバイオリアクター(SUB)を活用する利点について解説します。

Event
Tradeshow
Advanced Therapies Week 2025
Visit booth #541 at Advanced Therapies Week 2025 from January 20-23 in Dallas, Texas, to discover our CDMO services and solutions for advanced therapies, including cell and gene therapies.

ブログ
ヨーロッパの規制状況: Brexit 後の有資格者の要件を満たすための重要なアドバイスrequirements
英国(UK)の欧州連合(EU)離脱により、新型コロナウイルス関連の混乱に加えて、欧州の臨床試験サプライチェーンはさらに複雑さを増しました。
4 分で読めます

ブログ
真のバイオ医薬品製造の専門家である CDMO を選択する重要性
バイオプロダクションの業界では CDMO の数が増加しているため、新興のバイオ医薬品企業にとって、どの CDMO が自社に適しているかを判断するのは困難になる可能性があります
8 分で読めます
記事
遺伝子治療の未来を拓く:初期革新から商業成功まで、すべての段階でのウイルスベクターパートナー
この記事では、遺伝子治療の最前線に立つ2つの企業、NysnoBio社とbluebird bio社が直面するパートナーシップのニーズを深掘りします。異なる開発フェーズにある両社が、革新的な治療法を患者に届けるためにどのように最適なパートナーシップを築き、成功へと導いたのか、具体的な事例を通じて明らかにします。この記事を通じて、遺伝子治療開発の舞台裏と、CDMOとの戦略的協力の重要性をご覧ください。

ウェビナー
革新的なアプローチでコールドチェーンの複雑さを解決します
急速に進化するバイオテクノロジーおよび製薬業界において、温度に敏感な治療薬の流通に不可欠なコールドチェーン物流の課題と機会を探るウェビナーです。バイオ医薬品の完全性と有効性を保ちながら、効率的な保管、包装、配布を実現する最新の技術と戦略を紹介します。

パンフレット
分子のライフサイクルにおけるCMCおよび規制のロードマップの構築
分子の開発初期から戦略を立てることで、各フェーズをスムーズに進め、商業化までの時間とコストを節約します。私たちの規制専門家は、申請書類作成にとどまらず、強固で柔軟な規制戦略を共に構築し、スケールアップやサプライチェーン、各国の規制要件に関する課題解決を積極的にサポートします。

インフォグラフィック
カスタムウェアハウス(倉庫)ソリューションの5つのメリット
カスタムウェアハウスソリューションがどのようにして輸入/輸出戦略を簡素化するかを、分かりやすいインフォグラフィックでご覧ください。

ビデオ
リアルタイム・トラック&トレース・プラットフォーム
私たちの「リアルタイム・トラック&トレース・プラットフォーム」について詳細をわかりやすいビデオにてご覧ください。これは、コールドチェーン供給管理における比類のない監視機能を提供する最先端のソリューションです。

技術移転パート2:製薬技術移転における戦略的パートナーシップの価値
戦略的なパートナーシップは、技術移転の成功において重要な役割を果たします。これにより、プロセスのリスクを特定して軽減することができ、プロジェクトのスケジュールを守り、技術移転における一般的な課題を克服し、コストの大幅な削減を実現することが可能です。
10分で読みます

インフォグラフィック
信頼性の高い技術移管のために必要なCDMOの5つの特性
信頼性が高くシンプルな技術移管を確保するための戦略と、5つの重要な特性を備えたCDMOとの協力の重要性を探るインフォグラフィックをダウンロードしてください。

技術移転パート1:製薬製造における技術移転の重要な役割
効率的な技術移転は、製薬製造において、製品の品質を守り、知的財産を保護し、コストを管理し、スケールを拡大するために重要です。これにより、企業は新しいチャンスや課題に柔軟に対応でき、競争力を維持し、患者さんへの医薬品供給を途切れることなく続けることが可能になります。
15分で読めます

インフォグラフィックス
信頼性の高い技術移管を確保する9つの方法
製薬業界での技術移管を成功させるための9つのベストプラクティスをまとめたインフォグラフィックをダウンロードし、オペレーションの拡大や移行を円滑に進める秘訣を手に入れましょう。
ファクトシート
mRNA開発・製造CDMOサービス紹介
新しいワクチンや遺伝子治療の開発を含むmRNA治療薬の出現は、重要な原材料や技術的専門知識へのアクセスに市場の制約を生み出しています。
mRNA治療法の出現により、新しいワクチンや遺伝子治療の開発が進む中、重要な原材料や技術的専門知識へのアクセスに市場の制約が生じています。サーモフィッシャーのmRNAのCDMOサービスをご紹介します。

Blog post
医薬品開発の課題に応える: バイオ原薬のCDMOサービスに関するインサイダーの見解
今年のBIO International 2024では、世界中から業界リーダーや顧客が集まり、医薬品開発と製造の最新動向や課題について議論しました。弊社のバイオ原薬部門コマーシャルオペレーション担当バイスプレジデント、メイダー・パリク博士に、バイオ原薬の開発・製造に従事する顧客が直面する一般的な課題と、サーモフィッシャーサイエンティフィックのCDMOサービスがどのようにそれらに対処しているかについて、インサイダーの視点から語ります。
9分で読めます
記事
【最近記事】高品質と技術力で安定生産を実現する網羅的な経口固形製剤サービス
サーモフィッシャーサイエンティフィックの経口固形剤(OSD)CDMOサービスを紹介した記事です。(じほう社Pharma Tech Japan 2024年7月号)
サーモフィッシャーのグローバルネットワークと、多様なモダリティでの豊富な経験を持ち、顧客のビジネスを成功に導くサポートをしています。

専門家の視点 デジタル化による臨床試験サプライチェーンの最適化
治験薬がFDAや他国の規制当局から承認を受けるまでの道のりは、第I相から第IV相までの臨床試験を経て、多くのボランティアを対象に安全性と有効性が評価されなくてはなりません。しかし、現実は平均で約7.9%のみが承認を得ることができるという厳しい現実があります。
15 minute read
Infographic
IND/IMPDをより早く取得する5つの方法
IND/IMPDに到達する道のりは、決して容易ではありません。スピード、リスク、将来のニーズをバランス良く取り扱うことは難しいです。では、品質や将来の商業化を犠牲にせずに、どのようにして早くIND/IMPDに達することができるでしょうか?このインフォグラフィックでは、早期開発プロセスを加速し、最適化するための当社エキスパートの提案を紹介します。

Fact sheet
トランスレーショナルサービスの紹介
トランスレーショナル・リサーチ・サービスを通じて、サーモフィッシャーの学際的な科学専門家チームは、先端治療薬の開発者にエンド・ツー・エンドのサポートを提供し、関連資料を作成し、創薬から臨床段階の製造へのシームレスな移行を支援します。

Blog post
バイオリポジトリをアウトソーシングするメリットとデメリット
バイオリポジトリに関して、バイオファーマ企業はストレージのニーズをインソースすべきか、アウトソースすべきか?このブログでは、そのメリットとデメリットについて説明する
8 minute read

Blog post
ウイルスベクター製品の旅路を理解する: 主な成果物と製造上の考慮事項
遺伝子治療のためのウイルスベクター開発と製造において、CDMOが提供する革新的で統合された即戦力のソリューションを活用するメリットを解説します。バイオ製薬企業がCDMOと提携を選ぶ理由について、詳しくご紹介します。
20 minute read

Blog post
ウイルスベクターの開発と製造における統合的アプローチの利点の評価
バイオ製薬企業が社内での開発・製造ではなく、ウイルスベクターの開発・製造に豊富な経験を持つ総合的なCROやCDMOと提携を選ぶ理由をご覧ください。
15 minute read

Webinar
~ウィルスベクターCDMO最前線~ グローバルIND成功の鍵 : 前臨床開発からGMP製造までの一貫戦略
ウィルスベクターのグローバルIND成功に向けた 前臨床開発からGMP製造までの一貫戦略について、トランスレーショナルサービスから開発・商用生産に至るまで、サーモフィッシャーがどのようにサポートすることが可能か、ご説明いたします。(CPhI Japan 2024にて発表した内容)
記事
先端医療医薬品(細胞・遺伝子治療、mRNA)の開発の課題と解決に向けたヒントを探る
"先端医療医薬品(細胞・遺伝子治療、mRNA)の開発の課題と解決に向けたヒントを探る 細胞・遺伝子治療やmRNA技術の開発における課題にも関わらず、このセクターには大きな成長の可能性があり、パセオンはCDMO分野で技術力の向上に向けた積極的な投資を行っており、開発の課題と解決に向けたヒントについてまとめた記事です。"

eBook
「自宅に勝る場所なし:分散型臨床試験を患者、スポンサー、調査員にとっての成功を実現する方法」
このeBookでは、患者が自宅から参加できるDirect-to-Patientサービスが分散型試験の成功に不可欠である理由と、これらのサービスを活用して医薬品開発を改善する方法を探ります。
Fact sheet
対照薬および併用薬の調達サービス
当社の対照薬のエキスパートチームは、ローカルおよびグローバル市場にて、様々なニーズに対応して医薬品を手に入れる最も効果的で費用対効果の高い戦略の構築をどのようにサポートできるか、詳しくご覧ください。

ファクトシート
スマート・パッケージング - 臨床試験結果の信頼性を高めるサービス
パセオン・ファーマ・サービスのチームは、スマート・パッケージングに関して20年以上の経験を持っています。この経験とその活用方法について、詳しくはこちらをご覧ください。

オンデマンドウェビナー
中国における比較対照薬調達の課題と留意点について
臨床試験において対照薬を調達することは非常に重要ですが、特に海外での手続きは複雑です。中国における対照薬の調達課題に対する解決策をついてご説明します。是非ご視聴ください。

Infographic
細胞・遺伝子治療および先端医療医薬品の規制パスウェイ
細胞・遺伝子治療は急成長し、患者に治癒の可能性を提供しています。開発者は迅速な進展と新たな課題に直面しており、成熟する領域では規制対応のために規制当局と緊密な連携が必要です。この資料では、規制対応の成功に向けた3つのヒントを紹介します。

インフォグラフィック
最新のパセオンCDMOサービスアップデート
新規化合物は、人々の人生を変え、未来を形作る可能性を持っています。その医薬品の可能性を実現するには、信頼できるパートナーが必要です。この資料では、世界中のお客様のプロジェクトの成功に貢献してきたパセオンのCDMOサービスと実績についてご紹介します。
オンデマンド ウェビナー
注射剤の投与形態を変更する際の規制およびコストへの影響
様々な注射剤フォーマットの選択肢があるため、高分子医薬品を一つの投与形態での上市し、その後デリバリーフォーマットを変更することは珍しいことではありません。投与形態を変更する場合の規制やコストへの影響についてはこちらをご覧ください。

ビデオ
種細胞療法と自家細胞療法の現在と未来を探る:科学・製造・規制について
このラウンドテーブルでは、臨床と商業の専門家が同種細胞療法と自家細胞療法にまつわる複雑な動向を解説し、業界の現状と未来についての洞察を提供します。製造とロジスティクス、規制の状況とCMC要件、標準化の役割など、具体的なトピックに焦点を当てています。
記事
医薬品開発を促進する調和した戦略:初期段階と後期段階のプロセスの統一
こちらの記事ではサーモフィッシャーサイエンティフィック社が開発したGMPプラットフォームをベースに、創薬研究向けのAAVおよびLVベクターの製造において調和された合理的な手法を提案しています。技術とプロセスが一体化し、現代の要件に対応したアプローチを詳しく解説しています。

インフォグラフィック
細胞療法製造ワークフロー
遺伝子組換え細胞治療のワークフローと、プラスミド製造からコールドチェーン・ロジスティクスまでの各ステップにおける重要なポイントについてご紹介します。こちらの資料をご覧ください。

インフォグラフィック
臨床試験の成功に向けたコールドチェーンサービス
貴社におけるコールドチェーン管理は、高度な臨床試験の要件をフルにサポートできますか?このインフォグラフィックをダウンロードして、臨床試験の成功に欠かせないコールドチェーンサービスの詳細をご覧ください。

オンデマンド ウェビナー
製造イノベーション:連続生産のメリット
医薬品開発製造受託機関が固形製剤の連続生産サービスを提供し始める中、この製造技術の活用により、かつて可能であった事業とは異なる事業モデルを構築することが可能になっています。

オンデマンド ウェビナー
バイオ医薬品:開発から製造の加速化をサポートするEnd to End CDMOサービス
「グローバルCDMOの戦略的な活用法」 年々、バイオ医薬品の比率が増加しており、その開発と製造においてCDMOを戦略的に活用することが成功につながる方法の一つです。パセオンのバイオ医薬品のサービスについて日本語でご紹介いたします。

ファクトシート
グローバル・パッケージング・ソリューション
サーモフィッシャーサイエンティフィックが提供する治験パッケージングとラベリングのサービスは、30年以上にわたるグローバルな専門知識を基にしています。お客様のワークフローを合理化し、スピードアップするための柔軟な臨床供給サービスを提供しています。

ファクトシート
トータル・トランスポーテーション・マネジメント
トータル・トランスポーテーション・マネジメントは、あらゆる種類のライフサイエンス製品の国内外への輸送に必要な複雑なサプライチェーンプロセスを管理しています。
ファクトシート
ウイルスベクターサービス
パセオン・ウイルスベクター・サービスが15年以上の経験で積み重ねたノウハウ。細胞治療や遺伝子治療の分野でのイノベーションを支え、包括的な薬事コンサルティングサービスを提供しています。サービスの詳細をご覧ください。

ファクトシート
ウイルスベクター開発・製造サービス
サーモフィッシャーサイエンティフィックは、ウイルスベクター製品の開発・製造において20年以上の比類ない経験を有しており、エンドツーエンドの包括的なサービスを提供しています。詳細をご覧ください。

ファクトシート
毒性試験用ウイルスベクターサービス
毒性試験は、IND前の規制要件をサポートし、医薬品候補のリスク・ベネフィット比を評価するために極めて重要です。当社のDirect-to-Toxicologyウイルスベクター・サービス・プログラムは、アデノ随伴ウイルス(AAV)およびレンチウイルス(LV)の製造プロセスを通じて毒性学的材料へのルートを迅速化し、最短6ヶ月で完成させます。

ブログ
mRNA 治療薬のトレンド: パンデミックから学んだ成功への道
ファイザー・ビオンテックとモデルナのメッセンジャーRNAベースの新型コロナウイルス感染症ワクチンが研究室から診療所まで急速に進歩
5 分で読めます

eBook
臨床試験パッケージング: 革新的で柔軟、時間を短縮するソリューション
臨床試験パッケージングソリューションは、実際に保護する薬剤と同じぐらい多岐にわたります。我々の広範な試験で得られた経験は、スポンサーの緊急かつ長期的なニーズを満たすソリューションのデザインプロセスに導くことができます。
ブログ
服薬遵守と正確性:スマートパッケージが臨床試験における品質向上に貢献します
サーモフィッシャーの服薬遵守とバイオマーカー測定の責任者から、スマートパッケージのデータ品質に関する知見と、それを臨床試験にどのように統合するかを学びましょう。
15 minute read

ホワイトペーパー
対照薬の調達におけるBolar例外の活用: ジェネリック医薬品とバイオシミラー医薬品の市場参入を加速
サーモフィッシャーの対照薬チームは、Bolar例外(免除)の活用に必要な専門知識を有しており、お客様にはジェネリック医薬品/バイオシミラー医薬品への早期アクセス可能なサービスを提供しています。詳細はこちらより
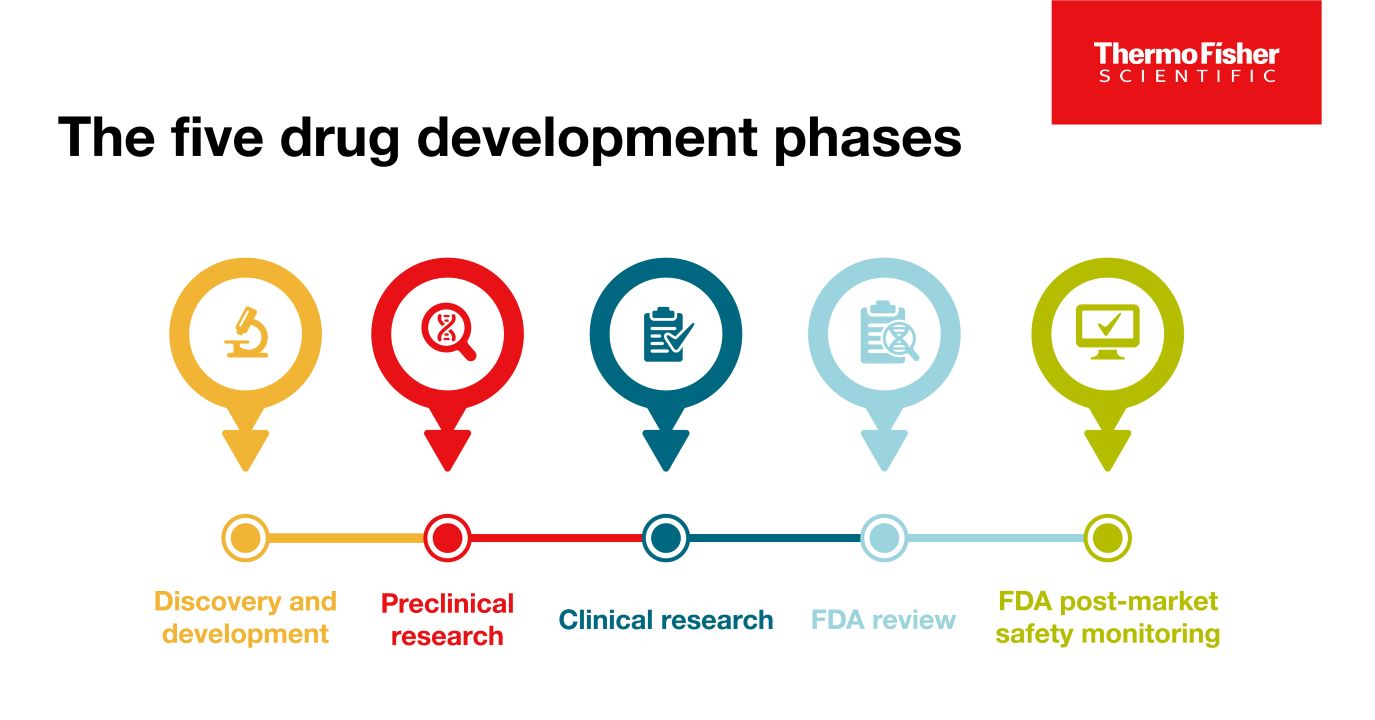
ブログ
医薬品開発における5つのフェーズ(段階)について
新薬が「成功」とみなされるためには、5つの段階を経る必要があります: 1)発見と開発、2)前臨床研究、3)臨床研究、4)FDA審査、5)安全性監視
9 minute read

ブログ
CROとCMOとCDMO: 3つの違いについて
CRO、CMO、CDMOは、いずれもバイオテクノロジー企業や製薬企業の医薬品開発・製造をサポートするものですが、それぞれの違いは何でしょうか?
9 minute read

ブログ
ウイルスベクターの商用化(パート2)‐ プロセス検証ライフサイクル
ウイルスベクターの安全性、有効性、品質を確保するためには、さまざまな評価と研究が必要です。これについて詳しく知りたい方は、頑健なウイルスベクタープロセスの検証サイクルをご覧ください。
11 minute read

ブログ
ウイルスベクターの商用化(パート1)‐ 技術移転
ウイルスベクターは、遺伝子治療やワクチンの革新的な開発を可能にし、その需要が急上昇しています。しかし、製造と商用化には高度な科学的専門知識と技術が必要となり、技術移転がキーの役割を担っています。
9 minute read

オンデマンド ウェビナー
一貫性あるCRO CDMO パートナーシップで細胞療法の患者サポートを最適化
このオンデマンド・ウェビナーでは、一貫したCRO/CDMOパートナーシップがどのように業界の課題を緩和し、開発から製造までのプロセスを加速するかに焦点を当てます
インフォグラフィック
バイオレポジトリ: 構築するか購入するかを決定するための10の考慮事項
温度変化に敏感な重要物質を保管する必要がありますが、社内で保管を管理すべきか、それともバイオレポジトリ・パートナーに委託すべきか迷っていませんか?このインタラクティブなインフォグラフィックで、考慮すべき重要な要素についてご覧ください。

ファクトシート
cGMP製造に向けたPOC試験のサポートサービス
当社ではトランスレーショナル・リサーチ・サービスを通じて、製薬会社向けにエンドツーエンドでサポートを提供します。先進治療法の開発者に対して、関連資料を作成し、発見から臨床段階の製造へのスムーズな移行をお手伝いします。
Infographic
バイオ原薬を成功へ導く!商用化に向け、リスクを減少し、成果を最大化する戦略
医薬品を作り上げる過程には、ラボから最終的な医薬品製造まで様々なステップがあります。だからこそ、スムーズな進行を実現するためには、計画と経験に裏打ちされた実践的なアプローチが欠かせません。後期開発をサポートするCDMOを活用することで各段階での課題を軽減することが可能です。詳細はこちらをご覧ください

Webinar
mRNA製品の商用化における業界の課題に迫る
COVID-19パンデミックでのmRNAベースワクチンの急速な開発・承認により、mRNA技術への新たな注目が高まり、科学者たちは腫瘍学、HIV、希少疾患、そして個別化医療などの新しい応用分野を模索しています。mRNAの生産速度と柔軟性は素晴らしいが、その潜在能力を最大限に引き出し、さらなる発展を遂げるためには、業界のいくつかの課題に果敢に取り組む必要があります。詳細はこちらをご覧ください

Infographic
mRNA 製造ワークフロー
このインフォグラフィックでは、mRNA製造の各ステップを詳しく解説し、サーモフィッシャーサイエンティフィックの柔軟なアプローチによって、mRNA製品をより速やかに臨床と市場に提供する方法についてご紹介します

Blog post
CDMOとは? 質の高いCDMOパートナーを探す7つのポイント
製薬企業とCDMO(医薬品開発・製造受託機関)がどのように連携しているか、そしてCDMOパートナーを選ぶ際に最も考慮すべきポイントをご紹介します。
9 minute read

オンデマンド ウェビナー
商用化に向けたウイルスベクター製造の準備
遺伝子治療用ベクターは急速に商業化されつつあるため、成功のためには商業化への準備が不可欠です。こちらのウェビナーでは、商業化に向けたウイルスベクターの準備に関する当社の能力とアプローチについてご紹介しています。

オンデマンド ウェビナー
適応可能な製造モデルが予測不可能な未来への着実な道をどのように切り開いているか
医薬品の研究開発は、より特殊な医薬品の開発に重点を置いており、その結果、ますます強力な API が開発されています。

視聴する
遺伝子治療の進化:統合的なアプローチがもたらすメリット
遺伝子治療用ウイルスベクターの商業化には、規制遵守、デザイン、仕様、サプライチェーン戦略の緻密な検討が欠かせません。このウェビナーでは、遺伝子治療用ウイルスベクターの開発と商業化において、ハードルを乗り越え、プロジェクトを効果的に進める方法を解説します。

ホワイトペーパー
品質の全体的な理解を通じて、CDMOとのパートナーシップを強化する
CDMO品質の重要な指標を詳しく掘り下げ、継続的な改善を促進し、協力を強化し、信頼を築くためのツールとベストプラクティスをご紹介します。

ブログ
CRDMOの興隆:未来の医薬品開発を切り拓く統合アプローチ
CROとCDMOの強力な連携から生まれた「CRDMO」が、新しい時代の扉を開こうとしています。今回、CRDMOとの提携がもたらす5つの魅力的なメリットに焦点を当て、未来の医薬品開発における真の可能性を探ります。
9 minute read

動画
How One Brave Patient Went from the Heart Transplant List to Climbing the Mountain Trails
“It felt like getting kicked in the chest by a horse.” That’s how Linda described the shock she received from her implanted defibrillator when she had one of her yearly “mini heart attacks.”

動画
Flexible Oral Solid Solutions From Early Development to Commercial Manufacturing
Thermo Fisher Scientific provides a range of flexible oral solid dose solutions that can help you easily address your small molecule’s unique needs and challenges from early development to commercial manufacturing.

動画
How Viral Vector Technology Is Rapidly Scaling up to Enable One Miracle After Another
The promise of viral vectors has been pursued for over two decades. But in the last few years, this transcendent technology that’s targeting over 200 diseases has finally started to create real treatments and possible cures.

動画
How a Small Non-profit Teamed up with a Global Manufacturer to Bring Their ALS Drug to Clinical Trials
Before she lost her own battle to ALS in 2003, Jenifer Estes started Project ALS, raising over $17 million dollars for the non-profit in hopes of a breakthrough in the fight against Lou Gehrig’s disease.

mRNA医薬品の商用化における業界が直面している課題への取り組み
「グローバルCDMOの戦略的な活用法」
COVID-19パンデミックの際にmRNAベースのワクチンが急速に開発され承認されたことで、mRNA技術への関心が再び高まり、科学者たちは腫瘍学、HIV、希少疾患、さらには個別化医療といった新たな応用分野が広がっています。

オンデマンド ウェビナー
遺伝子治療(ウィルスベクター)の開発と製造における統合的アプローチの利点
「グローバルCDMOの戦略的な活用法」 遺伝子治療用ウイルスベクターの商業化には、規制遵守、設計、仕様、サプライチェーン戦略の慎重な検討が必要です。

オンデマンド ウェビナー
注射剤の無菌充填(Fill Finish)の最前線CDMOサービス ~様々なモダリティに対応し、お客さんのニーズに応える~
「グローバルCDMOの戦略的な活用法」
最近、低分子薬からバイオ医薬品や遺伝子・細胞医薬品への需要が増加し、それに伴い注射剤の需要も増えています

オンデマンド ウェビナー
PPQの落とし穴:海外でバイオ医薬品を上市する際に気を付けるべき点・リスクの回避戦略
「グローバルCDMOの戦略的な活用法」
バイオ医薬品の製造には安定した製造プロセスが必要で、PPQレポートの作成と法規制への対応が重要です。適切なPPQ計画はリスクを減らし、市場投入までの時間を短縮します。このウェビナーでは後期バイオ医薬品開発の専門家がPPQの課題、リスク軽減策、文書化・データの重要性、CDMOとの連携について説明します。

オンデマンド ウェビナー
バイオ医薬品におけるグローバルのエンドーツーエンドCDMOサービスのご紹介 (2021年)
バイオ医薬品におけるグローバルのエンドーツーエンドCDMOサービスをご紹介します。(2021年版)

オンデマンド ウェビナー
遺伝子・細胞治療薬に関する治験薬サプライチェーンソリューション&コールドチェーンサービス
「グローバルCDMOの戦略的な活用法」国際化が加速している再生医療・細胞/遺伝子治療薬治験実施におけるサプライチェーンの課題、要求事項、またそれに対してサーモフィッシャーサイエンティフィックが提供する適切なシステム構築、信頼性の高いシームレスな安定供給の仕組作りをご案内いたします。

オンデマンド ウェビナー
研究開発からINDへの道のり – 避けるべき落とし穴と成功の秘訣
INDへの道のりは順風満帆ではありません。スピードとリスク、将来のニーズのバランスを取るのは難しい課題です。リスクを最小限にし、スケールアップと商業化の基盤を築く方法について,
また、ディスカバリーからFiH試験までのステップに焦点を当ててお話します。

インフォグラフィック
Direct-to-Patient(患者さんへの直接交付)サービス
上市最速化を目指し、治験の質を損なうことなく治験を速やかに実施することは、最も重要な成功要因となり、分散型臨床試験が有効とされています。この解説画像では、分散型臨床試験ためのサプライチェーンサービスを詳しくご紹介します。

記事
世界屈指のCDMOがサービスの幅を拡大 遺伝子治療製品でも業界随一のエンドツーエンドサービスプロバイダへ進化
創薬モダリティの多様化という市場トレンドの中で、今後大きく成長が見込まれ、さらに高いレベルでの経験・専門性が求められる遺伝子治療薬開発において、パセオンが提供しているエンドツーエンドのCDMOサービスについてわかりやすくご紹介した日本語の記事です。(Pharma Tech Japan 掲載)

パンフレット
総合カタログ:パセオンCDMOサービス
サーモフィッシャーサイエンティフィックの一員であるパセオンは、あらゆる規模の製薬・バイオ医薬品企業のお客様向けにエンド・ツー・エンドのCDMOサービスを提供しています。パセオンの提供するサービスの詳細はこちらのカタログでご覧ください

ブログ
PPQ(プロセス製造適格性評価)の複雑さを乗り越える
メソッドの認定は、プロセス性能認定 (PPQ) の前に非常に重要です。メソッドのパフォーマンス特性を早期に評価することは、メソッドの検証と、精度、精度、直線性などのパラメーターに関係するため、非常に重要です。
5 分で読めます

ブログ
Frank Ritacco, PhD
Director, Scientific and Technical Affairs
Scientific Expertise:
- Highly experienced in the development of cell lines, media, and culture conditions for the production of recombinant proteins and naturalmetabolites, as well as bioreactor operation, scale-up, cGMP manufacturing and technology transfer
- Research experience and skills include both mammalian cell culture and microbial fermentation (bacteria, yeast, filamentous fungi), process development, cellular physiology, and perfusion culture
Focus Area
Biologics (large molecule)
Credentials
Doctor of Philosophy in microbiology and molecular genetics from Rutgers University, NJ
Master of Science in microbiology and molecular genetics from Rutgers University, NJ
Bachelor of Science in biological sciences from Cook College, Rutgers University, NJ

ブログ
Keirnan LaMarche, PhD
Senior Staff R&D Manufacturing Scientist
Scientific Expertise:
- Tablet compaction
- Powder flow
- Continuous manufacturing of drug products
- Characterized and model drying processes, unit operators
- Fluid bed driers
- One-pot granulators
- Tablet coaters
Focus Area
Oral solid dose
Credentials
Doctor of Philosophy and Master’s degree in chemical engineering from Rutgers University
Bachelor’s degree in engineering, chemical engineering from The Cooper Union for the Advancement of Science & Art

ブログ
Matthew Jones, PhD
Senior Manager, Crystallization
Scientific Expertise:
- Crystallization process development, small molecules and biological macromolecules
- Particle engineering
- Downstream processes (solid-liquid separation and drying)
- Solid state chemistry and solid state analysis
Focus Area
API (small molecule)
Credentials
Habilitation (higher doctorate) in chemical engineering from MartinLuther-University Halle-Wittenberg, Halle (Saale), Germany
Doctor of Philosophy from the University of London, University College, U.K.

ブログ
Michael Cruskie, PhD
Sr. Director and General Manager, API (Small Molecule)
Scientific Expertise:
- Product development
- Small molecule APIs
- Strategy & process development
- Process improvement/optimization
- Operations and manufacturing
- Technology transfer
- Scale-up
- Supply chain
- Outsourcing
Focus Area
API (small molecule)
Credentials
Doctor of Philosophy in organic chemistry from the University of Florida
Bachelor’s degree in chemistry and mathematics from St. Lawrence University
Infographic
世界市場に展開するパートナーとしてのCDMOチェックリスト
医薬品を世界市場に展開する準備をされていますか?
パートナーとなるCDMOが、スピード感、セキュリティ、安定供給できる能力と共に、グローバルな規制対応を対応できる能力をしっかりと携えていることを事前に確認する必要があります。

Infographic
コンビネーションドラッグ戦略:認識されてない価値について
合剤は、単剤と比較して臨床的なメリットがあるため人気が高まっていますが、コンビネーションドラッグ戦略を活用することで、医薬品スポンサーが得られるビジネス上のメリットもいくつかあります。

ストーリー紹介
Meet Chris
How a small non-profit teamed up with a global manufacturer to bring their ALS drug to clinical trials.

ストーリー紹介
Meet Emily & Jessica
How in a culture of knowledge sharing, a mentor paved the way to success for their mentee.

ストーリー紹介

ストーリー紹介
Meet Angie
How a combination of teamwork, heart, and science ensured thousands of patients around the globe didn't go without medicine.

ストーリー紹介
Meet Jeff
How a small startup was able to scale up, without losing their precious material.

ストーリー紹介
Meet Justin & Joshua
How two college kids took a dorm-room idea all the way to clinical trials.

ストーリー紹介
Meet Katie
How viral vector technology is rapidly scaling up to enable one miracle after another.

ストーリー紹介
Meet Linda
How one brave patient went from the heart transplant list to climbing the mountain trails.

ストーリー紹介
Meet Pete & Lisa
How a combination of medicines helped one man take back his life, and inspire us all.

ストーリー紹介
Meet Holli
How spring break had to wait a little longer, so a baby could have a better shot.

ストーリー紹介
Meet Jigal & Jessica
How digging deep into Canadian regulations got a client's medication onto shelves in Brazil.

ストーリー紹介
Meet The Tubesings
How a family's perseverance helped them reach a seeemingly unattainable goal.

ストーリー紹介

インフォグラフィック
無菌製剤の処方が複雑化する10の理由
初期開発では、様々な課題が発生し次の開発段階への移行を妨げることがあります。 様々な要因により、無菌製剤の開発は複雑さを増していますが、処方の複雑化は、業界が注力する領域のシフトによるものです。
こちらの資料では、処方が複雑化する10の理由についてご説明いたします。

インフォグラフィック
ウイルスベクター製造における先を見据えたアプローチ
医薬品を世界市場に展開する準備をされていますか?パートナーとなるCDMOが、スピード感、セキュリティ、安定供給できる能力と共に、グローバルな規制対応を対応できる能力をしっかりと携えていることを事前に確認する必要があります。

インフォグラフィック

インフォグラフィック
FIH書類作成をきちんと行うことは重要です。こちらの資料では、共通技術文書(CTD)のフェーズに適した化学、製造、および管理(CMC)モジュールを作成する際に有益なチェックリストを提供いたします。
FIH書類作成をきちんと行うことは重要です。こちらの資料では、共通技術文書(CTD)のフェーズに適した化学、製造、および管理(CMC)モジュールを作成する際に有益なチェックリストを提供いたします。

eBook
米国とEUの細胞・遺伝子治療薬: 差別化できる5つの主要なポイント
「細胞・遺伝子治療薬(CGT)やその他の複雑な生物製剤の場合、米国とEUの規制プロセスは、単に管轄の監督だけでなく、様々な点で異なります。

eBook
製薬・バイオテクノロジー産業における持続可能性について
現在、我々は気候変動の転換期にあり、無駄にする時間は残されていません。私たちが互いに持続可能な道を歩んでいくためには、コラボレーションが不可欠です。

ファクトシート
遺伝子・細胞治療薬に関するCDMOサービスおよび治験薬サプライチェーンソリューション&コールドチェーンサービスの紹介
サーモフィッシャーが提供する最新の細胞治療薬、遺伝子治療、ウィルスベクター、プラスミドDNA,mRNAのCDMOサービス、および、治験薬サプライチェーンソリューションやゴールドチェーンサービスについて分かりやすくご紹介いたします。

オンデマンド ウェビナー
バイオ医薬品における中国へのゲートウェイ (新拠点:杭州・中国)
中国は米国に次ぐ世界第2位の医薬品市場であり、2021年の世界の医薬品売上高における市場シェアは約12%です。高齢化が進み、新たな適応症も増えているため、バイオ医薬品会社にとって、非常に魅力的な市場となっています。

オンデマンド ウェビナー
2022年以降のEUでのQPリリースについて(Q&A)
「グローバルな臨床試験市場で成功し、治験薬(IMP)をタイムリーに供給するためには、GMPと新しい法規制について議論し、理解を深めておくことが重要です。

記事
バイオ医薬品製造の技術移転を成功に導くポイント
バイオ医薬品の開発・製造を加速化させる最新のCDMOサービスの中でも後期開発・製造に焦点をあて、弊社で提供しているスムーズな技術移転とラージスケールの製造サービスについての講演内容を分かりやすく纏めました。

ポスター
湿式造粒から乾式造粒への切り替えと DoE 製剤による高 API 負荷即時放出錠剤の開発
このポスターを参照して、湿式造粒プロセスと乾式造粒プロセスの顆粒特性の違いと、ローラー圧縮によってタブレット API 負荷がどのように増加するかを学びましょう。

ポスター
ホットメルト押出プロセスの最適化と難溶性カルシウムチャネルブロッカー用の非晶質固体分散体の配合開発
ホットメルト押出を使用して非晶質固体分散配合物をどのようにスケールアップすることに成功したかについて詳しくは、このポスターをご覧ください。

ポスター
ポリマー賦形剤の使用による鎮痛/解熱薬の可溶化の強化
このポスターをチェックして、ソフトジェル剤形の BCS クラス I および II 薬剤の沈殿の課題に対処するための効果的な可溶化戦略について学びましょう。

動画
Vectoring In — Viral Vector Video Series
Preparing cell and gene therapies for regulatory submission
When preparing to ramp up late stage manufacturing for commercialization, understanding key critical to quality parameters will help prepare your therapy for regulatory submission.

パンフレット
業界をリードする細胞治療・遺伝子治療用ウイルスベクターCDMOサービス
パセオンは、14年以上にわたって細胞治療・遺伝子治療やワクチン用のウイルスベクターサービスに携わってきた経験を駆使し、プロセス・分析法開発から治験製品・市販製品製造までを総合的に支援するCDMOパートナーです。細胞治療・遺伝子治療が持つ可能性を最大限に引き出すことにより、バイオ医薬品ベンチャー企業、大手製薬企業のお客様が画期的新薬を患者さんのもとに届けるお手伝いをいたします。

インフォグラフィック
臨床試験出荷のためのリアルタイム追跡プラットフォーム
臨床試験出荷のためのリアルタイム追跡プラットフォームである、サーモフィッシャーサイエンティフィックのTrack and Traceソリューションは、社内外の臨床試験関係者に、臨床試験で輸送中の全て治験薬の出荷状況をオンデマンドで提供します。

動画
Bioprocessing Collaboration Center (BCC)
ミズーリ州セントルイスに新設されたバイオプロセシング・コラボレーション・センター(BCC)は、シングルユース技術やバイオ医薬品製剤の開発・製造において培った業界をリードする専門知識を結集した施設です。
記事
サプライチェーンロジスティクスにおける商用化に向けた準備について(細胞・遺伝子治療)
細胞・遺伝子治療市場の急速な拡大に伴い、イノベーターは、治療を必要とする患者に治療薬を安全かつ効率的に配送するための信頼できるサプライチェーンソリューションを必要としています。
記事
記事
記事
製品ライフサイクルにおける固体医薬品の特性評価と結晶化の役割の理解
固体医薬品の医薬品有効成分(API) の物理的特性は、単離、精製、および形状制御に使用する結晶化プロセスを決定し、効果的な製剤の開発を導きます。
記事
2022年以降のEUでのQPリリースについて:皆様からの質問への回答
「2022年以降のEUにおけるQPリリースについてご質問にお答えします」と題した最近のウェビナーで、サーモフィッシャーサイエンティフィックの臨床QP専門家2名が、英国とEUの間で臨床および商業用医薬品の供給を確保する上での英国とEUのQPの期待と責任について論じました。この記事では、彼らの見解と主要な質問に対する回答が共有されています

ブログ
電子ラベルを採用する時期が来ていますか?新しい EU 臨床試験規則に基づくラベル表示ソリューションの可能性
新しい EU 臨床試験規制 (CTR) は、臨床試験の管理を簡素化し、欧州で事業を展開する製薬会社にとってより歓迎的な環境を作り出すことを目的としています。
5 分で読めます

ブログ
パッケージングについて考え始める時期が来ましたか?
この見出しが目に留まった場合は、有望な前臨床結果が得られ (おめでとうございます!)、次のステップの計画を考え始めているからかもしれません。
2 分で読めます

ブログ
API を次のレベルに引き上げる: アウトソーシングする前に考慮すべき 3 つのステップ
API 開発のアウトソーシングが一般的になるにつれ、潜在的な開発パートナーとして競合する複数の受託開発製造組織 (CDMO) が台頭すると考えられます。
10 分で読めます

ブログ
OTCノイズを打ち破る
それは秘密ではありません。消費者は、お気に入りの店舗やオンライン小売店で幅広い OTC オプションを利用できます。錠剤やカプセルからシロップに至るまで、OTC ジャングルの中で消費者にはこれまで以上に多くの選択肢があります。
8 分で読めます

ブログ
希少疾病用医薬品の開発を妨げる考慮事項と障害
米国食品医薬品局(FDA)によると、「2020年は、希少疾病用医薬品開発局に提出された希少疾病用医薬品指定および希少小児疾患指定申請の数において、記録的な年となった」とのこと。
6 分で読めます

ブログ
新型コロナウイルス感染症の希望の光: ワクチン開発の加速
ワクチン開発は長いプロセスであり、費用がかかり、人員の減少が多く、認可されたワクチンをすべての人に届けるには、候補を複数回繰り返す必要があります。パンデミックや伝染病に対するワクチン開発にはリスクが伴い、ウイルスの新しい性質により、特定の未知の要因によってワクチン計画が狂う可能性があります。
6 分で読めます

ブログ
連続製造: OSD 医薬品を生産する効率的な方法
1913 年にヘンリー フォードがミシガン州ハイランド パークで製造慣行に革命を起こしたとき、彼の主な目標は単純でした。つまり、最も効率的かつ費用対効果の高い方法で可能な限り最高の製品を作るということでした。フォードは、従業員やテクノロジーがよりスマートに働き、原材料の無駄を削減できるように製造の「フロー」を改善することに重点を置き、製造原則を永遠に変えました。
6 分で読めます

ブログ
分散型臨床試験が新型コロナウイルス感染症の時代にどのように患者中心性を高めるか
新型コロナウイルス感染症により、バイオ医薬品業界でのビジネスのやり方が変化し続けているため、患者の命を改善し救うという、なぜ私たちがやっているのかを見失わないことが重要です。
5 分で読めます

ブログ

ブログ
プレフィルドシリンジ: 考慮されていないかもしれない 3 つの問題点
製薬会社がより患者中心になろうとするにつれ、特定の医薬品がその取り組みをサポートするために最前線に立つようになりました。
5 分で読めます

ブログ
細胞および遺伝子治療の規制をナビゲートする: 貴社の CDMO はどのように適合しますか?
大規模なバイオテクノロジー企業であっても、新興の新興バイオテクノロジー企業であっても、多くの企業は、規制当局への申請を適切にサポートするための社内リソースや専門知識が不足していると感じています。
7 分で読めます

ブログ
機器認定の 4 段階
前回のブログで説明したように、認定とは、特定の機器、設備、またはシステムが意図した用途に適合し、準備ができていることを文書化した証拠を確立するプロセスです。
3 分で読めます

ブログ
あなたのサプライチェーンは完璧ですか?
応答する前に、ハリケーン、ノーイースター、津波について考えてください。地震、台風、火山の噴火。内乱と戦争。テロ。パンデミックウイルス。
2 分で読めます

ブログ
臨床ラベルの翻訳と規制要件を管理する方法に関する重要なヒント
臨床試験に含まれるすべての国のラベル翻訳と規制要件を常に把握する方法を見つけられたら素晴らしいと思いませんか?
2 分で読めます

ブログ
ワクチン用のバイアルからプレフィルドシリンジへの移行: 3 つの重要な成功要因
製薬会社がより患者中心になり、注射薬の自己投与が増加し続けるにつれ、プレフィルドシリンジの医薬品市場は成長し、2026 年までに 95 億 3,000 万ドルに達すると予測されています。
4 分で読めます
ブログ
mRNA を成功させるための CDMO の選択: 必要な CDMO の 5 つの特徴
mRNA テクノロジーの有望性は、ワクチンが記録的な速さで市場に到達するなど、新型コロナウイルス感染症のパンデミック中に明確に実証されました。
7 分で読めます

ブログ
EU と米国の規制: 細胞治療と遺伝子治療に何が起こるのか?
細胞および遺伝子治療 (CGT) の開発者は現在、臨床試験を経て製品を市場に投入するというさらなる課題に直面しています。詳細については、このブログをお読みください。
7 分で読めます

ブログ
API をより深く理解する
医薬品原薬 (API) がますます複雑になるにつれて、スケジュールが延長され、予算が急増する可能性がある潜在的な製剤上の問題が生じます。詳細については、このブログをお読みください。
5 分で読めます

ブログ
統合されたビジネスプロセスを通じてデジタル文化を実現する
安定性と経験が鍵となる物理的な作業環境とは対照的に、デジタル ビジネス環境ではイノベーションと接続性に重点が置かれます。
4 分で読めます

ブログ
First-in-Human の一般的な技術文書に適切な量の詳細を提供するための重要なヒント
開発の初期段階では、薬剤の特性についてはほとんどわかっていない可能性があります。さらに、試験や治験の後にさらに多くの情報が明らかになるにつれて、医薬品のプロセスや製剤は頻繁に進化します。もっと詳しく知る。
5 分で読めます

ホワイトペーパー

オンデマンド ウェビナー
細胞および遺伝子治療のための輸送ソリューション
このウェビナーは、宅配業者とインテグレーターに期待されるサービス レベルなどの基本から、国内線と国際線のレーンを評価する方法、そして最後にリスクとコストのバランスを取る方法に至るまで、臨床サプライ チェーンへの取り組みを開始する方法を理解するのに役立ちます。
記事
バイオ医薬市場で生き残るための鍵を握るCDMOの存在
最新のバイオ医薬品のCDMOサービスについてご紹介した記事です。
ファームテクジャパンWEBセミナー『Bio Pharma Week 2021 Autumn』で、パセオンが展開するバイオ医薬分野での多様なサービスを紹介し、市場での競争力向上においていかにCDMOが重要な役割を担うかを示唆した記事レポートです。
(Pharma Tech Japan 2022年2月号 記事掲載)

記事
高付加価値医薬品の低コスト・スピードアップ開発への ツール・技術を提案
「難溶解性候補化合物の課題解決・プレフィルドシリンジへの剤形変更戦略」
2021年4月15日から東京ビッグサイトで開催されたCPhI JAPAN 2021の出展社セミナーで当社はSanjay Konagurthu氏とVincenza Pironti氏から製剤の溶解性改善の切り札となる新 たなツールや、今後市場拡大が見込まれているプレフィルドシリンジに関する最新技術などを紹介した。

記事
遺伝子・細胞治療サービスをスタート、 他の追随を許さない圧倒的な実績と技術が武器
2020年10月15日、パシフィコ横浜で行われたBioJapan 2020のスポンサーセミナーにて、パセオン株式会社による「最新のパセオンCDMOサービス」の講演が行われた。

記事
サーモフィッシャー(パセオンCDMO) のクオリティカルチャーへの取り組み
2020年のじほう社のクオリティカルチャーについての特集号に掲載された、パセオンにおけるクオリティカルチャーの取り組みについて事例をもとに詳しく説明した記事になります。

ケーススタディ
コスト削減とスピードアップ:外部委託の一本化の隠れた価値
臨床入り、そしてproof-of-concept(POC)取得を目指す小規模ベンチャー企業は、限られた予算と資源で速やかに開発を進めなければなりません。
ケーススタディ
代表者への直接サンプル配布サービス
業界規制への完全な準拠を確保しながら、製品ロスを最小限に抑えるための効率的なサンプル配布プログラムの設計を製造会社がどのように支援したかをご覧ください。

ケーススタディ
高精度シリンジラベリング
さまざまな長さのシリンジに用量スケールを含むラベルを貼り付けることで、市販の医薬品をシリンジに目隠ししなければならなかった顧客が、高精度ラベルによってどのように役立ったかをご覧ください。

ケーススタディ
柔軟性の高い自動包装ラインで添付文書の大型化に対応
サーモフィッシャーサイエンティフィックのフェレンティーノ拠点では、ある大規模グローバルファーマから、添付文書の大型化により生じた問題の解決を依頼されました。

ケーススタディ
世界的な超低温臨床試験物流
課題: 米国に本拠を置き、初の細胞療法ベースの治療に取り組んでいる新しいバイオ製薬会社は、治験の範囲を拡大し、中国の北京の患者を含めて患者プールを拡大しました。

ケーススタディ
トータル・トランスポーテーション・マネージメントサービスで10.2百万ドルを節約
広範な臨床試験パイプラインを持つ大手多国籍製薬会社は、包括的で完全に管理された輸送戦略を実現する必要がありました。

ケーススタディ
原薬製造を委託すべき医薬品受託製造開発機関医薬品(CDMO)の選択の重要性:クライアントの視点
資金・資源の制約により、技術力、専門知識や生産能力などの課題に直面している小規模新規ベンチャー企業では、優秀なパートナーとの提携が極めて重要です。

ケーススタディ
COVID-19ワクチンの世界的な需要に応えるための弊社の取り組みについて
この2年間、世界を震撼させたCOVID-19の世界的に大流行しています。公衆衛生と経済危機の両方を引き起こしたこのパンデミックは、第二次世界大戦終結後、文明に対する最大の脅威と言われています。

ケーススタディ
大きなスケールの医薬品をスピーディに提供するには
ある製薬会社が、第III相臨床開発プログラムをサポートするために、難しい化学薬品を5段階で導入、製造、検証する必要があったとき、サーモフィッシャーサイエンティフィックの医薬品サービスチームはその仕事を成し遂げる必要がありました。

ケーススタディ
Quality by Designを適用した新規ALS治療薬のプロセス開発・スケールアップ
Amylyx Pharmaceuticals社は、筋萎縮性側索硬化症(ALS)治療薬として開発中のリード化合物AMX-0035の上市を目指し、サーモフィッシャーサイエンティフィックと提携しました。

ポスター
PVP VA64 非晶質分散体を含む錠剤製剤を最適化するための品質による設計アプローチ: 製剤変数
当社の科学者によるこのポスターをお読みください。QbD アプローチを使用して、親水性ポリマーを含む非晶質固体分散体の固体剤形でよく遭遇する製剤の課題に取り組んでいます。

ポスター
経口 N 型カルシウム チャネル遮断薬の安定性の加速評価
このポスターをご覧になり、このケーススタディで実証されているように、ASAPprime® による加速安定性の評価が時間効率の良い方法での保存期限予測にどのように役立つかを詳しくご覧ください。

ポスター
ソフトゼラチンベースの剤形中のBCSクラスII分子の溶液ベースおよび懸濁液ベースの製剤のPK性能の比較
ソフトジェル剤形における難溶性分子の吸収とバイオアベイラビリティを高めるために、当社の専門家が提示したこれらの戦略的製剤アプローチを検討してください。

ポスター
ソフトゼラチンベースの剤形での OTC 咳止め薬の制御放出
さまざまな薬物の放出を調整して有害事象を最小限に抑え、有効性を最大化するのに適したソフトジェルでの制御放出に関するこのポスターをご覧ください。

ポスター
凍結乾燥: 小規模スケールと大規模スケールの比較
このウェビナーを視聴して、凍結乾燥の製薬業務と、パイロット凍結乾燥ユニットと大規模凍結乾燥ユニットの比較可能性へのアプローチについて説明します。

ポスター
新規 ALS 医薬品のプロセス開発とスケールアップのためのクオリティ バイ デザイン (QbD) アプローチの評価
このポスターでは、新規 ALS 医薬品の品質を構築するための、ICH Q8 (R2) および関連する規制ガイドラインに準拠した段階的な品質バイデザイン (QbD) アプローチについて説明します。

ポスター
自動カプセル化装置を使用した医薬品のカプセル化のための投与ディスクとカプセル化速度の決定
自動カプセル化装置を使用する際に分注ディスクとカプセル化速度を最適化する方法については、このポスターをご覧ください。

ポスター
医薬品混合プロセスの個別要素モデリング
当社の科学ポスターを読んで、離散要素法 (DEM) を使用して医薬品混合装置の操作のスケールアップを予測するための機構モデルを開発する方法を学びましょう。

ポスター
BCS クラス IV 医薬品の即時放出錠剤の顆粒特性に対する噴霧乾燥プロセスのパラメーターと装置の種類の影響を評価する
このポスターを参照して、噴霧乾燥プロセス パラメーターを使用することで顆粒の粒子サイズを大きくし、内容物の均一性のばらつきを減らす方法を学びましょう。

ホワイトペーパー
希少疾患への挑戦:高分子のオーファンドラッグ開発における重要な検討事項
希少疾患の治療薬製造では、小規模生産、限られた時間・データ、少ないサンプル量、コストにおいて独自の課題があります。

ホワイトペーパー
多剤混合薬:ベストインクラスの製品を市場に送り出すための革新的な製剤・開発戦略
多剤混合薬(FDC)は、高血圧、糖尿病、癌、結核、喘息、COPDなど多くの疾患や症状の治療において、単剤療法に代わる重要な選択肢となっており、さらに多くの疾患に対して有望視されています。

ホワイトペーパー
First-in-Human試験の開始:小規模のバイオ医薬品企業の成否を分けるマイルストーン
「より速く、より的確に」が信条となっているバイオ医薬品企業各社では、かつてない上市スピードが求められるというプレッシャーに直面しています。

ホワイトペーパー

ホワイトペーパー

ホワイトペーパー
経口固形製剤の適応拡大によるライフサイクルマネジメント戦略
有望な大型新薬パイプラインがほとんどない現在、各製薬企業は、経口固形製剤(OSD)市場における患者さんのニーズを満たし、収益を高めるため、様々な選択肢を模索しています。

ホワイトペーパー
開発を遅らせる可能性がある 6 つの API の課題とその回避方法
ほとんどの API では、開発の遅延、やり直し、または完全な失敗を回避するために、多数の手順や大幅な作業を事前に行う必要があります。

ホワイトペーパー

Whitepaper
品質による設計: 医薬品開発への総合的なアプローチ
QbD を早期に導入したスポンサーが、製品/プロセスの知識の向上、再作業の減少、製品の逸脱の減少、仕様外の製品の減少、不良品の減少、品質の向上を通じてどのようにコストを節約できるかを学びましょう。

ホワイトペーパー
戦略的なCDMOのパートナーシップ:インフラ投資とイノベーションを活用してバイオ医薬品の開発を加速する
破壊的な変化の時代にバイオ医薬品開発の課題に立ち向かうには、変革を推進する科学、技術、市場の力を理解し、これらの変化に合わせた戦略を積極的に採用する必要があります。

ホワイトペーパー

ホワイトペーパー
バイオ医薬品のプロセス特性解析・バリデーションについて知っておくべきこととは?
過去20年間のバイオ医薬品業界の成長を推進した大きな要因の1つが、今やバイオ医薬品市場全体の50%以上を占めているモノクローナル抗体(mAb)の継続的なイノベーションです。

ホワイトペーパー
EMEAにおけるエンドツーエンドファーマサービシズ(CDMO) ネットワーク
サーモフィッシャーサイエンティフィックのファーマサービスは、お客様の医薬品開発の総合的なパートナーです。EMEAの科学者やエンジニアから、ラインオペレーターやビジネスプロフェッショナルに至るまで、私たちは皆、個人的にこの仕事に携わっています。

ホワイトペーパー
in silico モデリングによる医薬品開発の推進
データは知識であり、知識は力である。しかし、それは実用可能でなければなりません。こちらの予測モデリングは、堅牢な医薬品開発および製造プラットフォームの開発を支援することが可能です。

ホワイトペーパー
低分子のオーファンドラッグ。財政的インセンティブと複雑な課題のバランス
オーファンドラッグの上市を目指す企業にとって、承認申請までの道のりを成功裏に進めるには、臨床試験までのスピードとコストのバランスをうまく取ることが必要です。

ホワイトペーパー
mRNAワクチン開発について:プラニング、ワークフロー、サプライチェーンの成功のための重要な洞察
本レポートでは、mRNAベースのCOVID-19ワクチンの開発から得られた主要な洞察をレビューし、今後mRNAワクチンおよび治療薬の製造の進展を加速するためにどのように適用できるかを、以下の点に焦点を当てて説明します。

ホワイトペーパー
医薬品の開発・製造の外部委託を一本化する経済的メリット
Tufts Center for the Study of Drug Development(タフツ医薬品開発研究センター:CSDD)は、「シングルソースモデル vs マルチベンダーモデルの経済性評価」と題し、複数の受託製造開発機関(CDMO)に委託するモデルと委託先を1社に絞ったモデルの開発時間及び開発費用を比較した研究結果を最近発表しました。

ホワイトペーパー
第III相試験に備えた製造工程のスケールアップ:順風満帆か、それとも波乱万丈か?
企業によっては、開発初日から処方設計にスケーラビリティを作り込み、第III相試験の大規模製造の準備を整えておく場合もあるでしょう。しかし、第III相になると、錠剤、バイアルなど剤形を問わず、予測困難な問題が発生することが少なくありません。

ホワイトペーパー
API とその定式化の間の非互換性による影響を回避するにはどうすればよいでしょうか?
医薬品開発では、医薬品 (錠剤など) の処方を設計する際に、医薬品有効成分 (API または原薬) の物理的および化学的特性の両方に細心の注意を払う必要があります。

ホワイトペーパー
パンデミックによるワクチン開発手法の変革
ワクチン開発には常に障害が伴います。しかし、パンデミック下でのワクチン開発においては、特有の複雑な課題があり、従来の製造方法では解決できません。

ホワイトペーパー
細胞治療および遺伝子治療製品のCMC規制の状況を理解する
すべてのバイオテクノロジー製品と同様に、命を救う医薬品の早期の上市は、規制当局の査察に対する準備ができていなければ、遅れる可能性があります。

ホワイトペーパー
細胞・遺伝子治療製品のプロセスバリデーションの複雑さを克服する
複雑な細胞・遺伝子治療(CGT)製品では、開発・商業生産ライフサイクル全体にわたって、頑健なプロセスに関する知識を蓄積することが求められます。

ホワイトペーパー

ホワイトペーパー

ホワイトペーパー

ホワイトペーパー
患者を中心とした経口固形製剤とは。 製品のライフサイクルを通じたアクセスと価値の向上について
患者は、自分自身のヘルスケア管理において、より中心的かつ積極的な役割を果たすようになっており、より患者中心の医薬品に対する要求を煽っています。

ホワイトペーパー
バイオ医薬品における堅牢なCMC書類を作成するための5つの戦略
バイオ医薬品をFIH臨床試験に進めるには、複雑なバイオ医薬品特有の科学的・規制課題を深く、そして細部まで理解する必要があります。

ホワイトペーパー
注射剤のプレフィルドシリンジ製剤への切替えにおける課題と実践的ソリューション
開発・治験段階をバイアルなどの他の剤形で行った後、プレフィルドシリンジとして上市するケースは少なくありませんが、このような切り替えは慎重かつ戦略的に行わねばなりません。

ホワイトペーパー

ホワイトペーパー
EU臨床試験規則2022:欧州の臨床研究への影響を理解するために
EU臨床試験規則(CTR)2022は、採択から8年後に適用され、EU加盟国および欧州経済領域(EEA)諸国における臨床試験実施の規制状況を根本的に変更した。

ホワイトペーパー

ホワイトペーパー
「万が一の場合」を考慮した供給予測 治験実施において持続可能なサプライチェーンを構築すべき理由
従来、治験薬供給は治験計画立案段階の重要な要素ではなく、実施段階で考えるべき事項とみなされていました。

オンデマンド ウェビナー
First-in-Human(FIH)試験用経口剤/注射製剤の開発期間短縮
バイオベンチャー企業では、様々な理由から初期開発に時間がかかることが少なくありません。スピード、品質、リスク、投資の最適なバランスを取ることにより、開発期間を短縮し、作業を効率的に進めることが可能です。

オンデマンド ウェビナー
サプライチェーンのシンプル化による第I相試験の早期開始
こちらのセッションでは、この分野のエキスパートKevin Kane, PhDとIain McGroarty, PhDが、第I相試験入りというマイルストーンを目指す過程において、シンプルなサプライチェーンがどのように開発効率の向上とリスク低減を実現するかについて考察します。

オンデマンド ウェビナー
世界的な景気変動下における安定したサプライチェーンの確保について
安定したサプライチェーンは、医薬品を時間通りに製造し、患者さんに届けるために不可欠です。しかし、世界経済が戦争、天候、労働力不足の理由で揺らいだとき、生産に必要なサプライを入手することは、高価で信頼性の低いものになりかねません。

オンデマンド ウェビナー
技術移管:成功確率を高め、リスクを低減するベストプラクティス
緊密に連携するネットワークを持つ適切なパートナーと提携し、製造技術を移転することにより、様々な戦略的メリットを獲得することができます。

オンデマンド ウェビナー
ワクチン開発:パンデミックに対する戦略的アプローチと対応
過去10年間には、H1N1インフルエンザ、SARS(重症急性呼吸器症候群)、エボラ出血熱、MERS(中東呼吸器症候群)の流行が発生し、パンデミック(世界的大流行)・エピデミック(特定地域での流行)に対する戦略的アプローチと対応について議論が行われてきました。

動画
How two college kids took a dorm-room idea all the way to clinical trials.
Watch the video to learn why companies like Amylyx are choosing to partner with Thermo Fisher Scientific for their outsourcing needs.

オンデマンド ウェビナー
経口固形製剤の開発・製造におけるリスク評価戦略
医薬品開発の各段階では、製品のスケールアップを図る際に注意すべき項目が数多くあります。開発初期から商業規模に至るまで、原薬や製剤の変更がもたらす潜在的な影響について、最善の策を講じることが必要です。

オンデマンド ウェビナー
細胞・遺伝子治療製品を商業化するための柔軟な規制対応とCMCにおいて考慮すべき事項
近年、細胞治療と遺伝子治療のパイプラインは急速に拡大しており、アンメットメディカルニーズの高い疾患を治療する大きな可能性を秘めています。

オンデマンド ウェビナー
ブレイクスルーセラピー指定。トレンドとCMC戦略への影響の評価
ブレイクスルーセラピー指定は、重篤な疾患や生命を脅かす疾患の治療を目的とした新薬の開発および審査期間の短縮を支援するために、米国FDAが導入した制度です。

オンデマンド ウェビナー
ウイルスベクターの生産能力・製造技術を構築し、遺伝子治療の可能性を実現する
こちらのセッションでは、サーモフィッシャーサイエンティフィック、Viral Vector ServicesのVice President兼General ManagerであるChris Murphyが、ウイルスベクター製品の上市における課題と機会について解説するとともに、サーモフィッシャーにおける遺伝子治療の可能性実現のための生産能力・製造技術の構築方法についてご紹介します。

オンデマンド ウェビナー
従来型・非従来型の噴霧乾燥技術:開発から上市まで
こちらのセッションでは、多くの原薬で直面するバイオアベイラビリティーや結晶化の課題を解決する戦略的噴霧乾燥法について、サーモフィッシャーサイエンティフックのグローバルネットワークで活躍するエキスパートが考察します。

オンデマンド ウェビナー
患者さんのニーズを満たす治験デザインとは?
分散型臨床試験は、COVID-19パンデミックが始まる前から増えつつありましたが、各治験に適しているかどうかをどのように判断すればよいのでしょう?

オンデマンド ウェビナー
細胞治療の臨床試験におけるサプライチェーンの生産性向上について
細胞治療や遺伝子治療の臨床サプライチェーンにおいて、リスクを軽減するために事前にリスクを特定し、計画する方法をご存知でしょうか? また、商業的に成功するための準備として、データを活用する最善の方法を考えていらっしゃいますか?

オンデマンド ウェビナー
進化するEUの規制環境における分散型臨床試験の未来
COVID-19のパンデミックによって、臨床試験において、施設ベースの取り組みから完全な分散型またはハイブリッド型に適応させることの実現可能性を示し、臨床研究を加速させる安全かつ効果的な選択肢として分散型臨床試験が世界的に受け入れられるようになりました。

オンデマンド ウェビナー
FIH試験の開始:堅牢なCMC書類を作成するための5つの戦略
バイオ医薬品のFIH試験を進めるには、これらの複雑な高分子物質に特有の科学的・規制的課題を深く、微妙なニュアンスまで理解することが必要です。

オンデマンド ウェビナー
スマートパッケージング:アドヒランスデータ(治験時の薬剤服用データ等)の有益性
「患者への投薬時に受動的に取得される個人のデータの価値は、あまり取り上げられていませんが、実はこれらのデータポイントを経時的に見ると、個々の患者の服用行動に関する深い理解が得られ、患者が何回服用したかだけでなく、服用と服用の間の時間についてもより良く理解するために使用することができます。

オンデマンド ウェビナー
医薬品開発の初期段階において、正しくキャラクタライズされた分子を確立すること
APIの物理的特性は、単離、精製、形状制御のための結晶化プロセスを大きく左右し、効果的な製剤開発の指針にもなります。

オンデマンド ウェビナー
固定用量配合剤の開発:アジャイルかつ迅速なライフサイクル戦略の構築
固定用量配合剤や適応拡大は、個々の医薬品の価値向上を目指して広く採用されているライフサイクルマネジメント戦略であり、多くの場合、新たな適応症での副作用を抑えたり、臨床効果の評価を減らすことが可能です。

オンデマンド ウェビナー
グローバルにおける低分子化合物のCMC規制戦略を一から構築するには
医薬品開発はダイナミックであり、各ステップでCMC規制のインプットが必要です。そのため、CMC規制のプロセスや分子のライフサイクルを全体的に考えることなく、大枠でのタスクに焦点を当ててしまいがちです。

オンデマンド ウェビナー
バーチャルインスペクション査察:新たなパラダイムを切り開く
バイオロジックスに関する規制状況を理解することは不可欠である。申請を進めるためには、変更点を理解する必要があります。このウェビナーでは、以下について説明いたします。

オンデマンド ウェビナー
mRNAワクチンのトレンド、技術、サプライチェーンについて
過去10年間でH1N1インフルエンザ、Sars-Cov、EbolaおよびMERSの発生は、パンデミックおよびエピデミックへの戦略的アプローチと対応についての継続的な会話が行われてきました。

オンデマンド ウェビナー
適切な意思決定による早期上市の実現
バイオ医薬品の開発成功には、バリデーションから上市までの道のりに伴うリスクや要件、課題の理解が不可欠です。資源や技術力・専門知識が不足している場合など、初期開発において重要な意思決定を適切に下すことは簡単ではありません。

オンデマンド ウェビナー
オーファンドラッグの開発における優遇措置と様々な複雑な課題のバランスをいかにとるか
オーファンドラッグは、患者数が少なく、開発・上市コストがかかることから、高コスト・高リスクであることがよく知られています。このような高リスクのニッチ市場であるにもかかわらず、オーファンドラッグの開発には優遇措置が適用されるなどのメリットがあるため、成長し続けています

オンデマンド ウェビナー
革新的かつスケールアップ可能な技術の実践的活用によるバイオ医薬品の開発・上市の最速化:医薬品開発製造受託機関(CDMO)の視点
こちらのセッションでは、新しい革新的技術とベスト・イン・クラスの製造設備を用いて、バイオ医薬品開発における様々な課題を解決する方法についてご紹介します。

オンデマンド ウェビナー
細胞・遺伝子治療の商業化を成功させるための、進化する規制環境への対応
細胞・遺伝子治療は、臨床試験を経て、商業化に向けて急速に進展しています。その結果、規制当局は、開発のペースをサポートするためのガイダンスを提供するために、迅速に対応しなければならなくなりました。

オンデマンド ウェビナー
プロセス特性解析:FDA/EU ICHガイドライン遵守を確保する
世界各国の規制当局の間には、バイオ医薬品の製造販売にはプロセスバリデーションが必須であるとの共通の認識があります。プロセスバリデーションは、製品のライフサイクルを通したリスク低減と品質確保により患者さんを守るうえで、極めて重要な要素であるからです。

オンデマンド ウェビナー
Qualified Person(QP)による出荷:欧州において治験薬・市販製剤に期待される事項と責務
複雑な国際共同治験を円滑に進め、スケジュール通りの治験薬供給を確保するには、関連法令の理解が欠かせません。欧州外の製薬企業の場合、欧州 GMPの要件とQPの役割・責務を理解することが重要です。新薬や既存薬を欧州で販売するためにQP認証を迅速かつ効率的に取得するにはどうすればよいでしょうか?

オンデマンド ウェビナー
毒性学者から見た抗がん剤開発のポイント
がんの成長率が上昇する中、製薬会社は命を救う治療薬を迅速かつ俊敏に開発・製造することを求められています。がんの増加率は、環境要因、ライフスタイルの選択、人口の高齢化によって左右されます。オンコロジー市場のパイプラインの約42%は経口固形剤に起因しています。

オンデマンド ウェビナー
連続生産方式による医薬品後期開発の最速化
経口固形製剤のプロセス開発は複数の開発相にわたって行われ、スケールアップされた最終プロセスが完成するのは、承認申請直前であるのが普通です。連続生産は、第III相開発・治験薬製造に非常に適した方法であり、品質保証の強化と原薬使用量の削減により、円滑な後期開発を実現します。

オンデマンド ウェビナー
革新的技術の実践的活用による細胞培養プロセス開発の最速化
バイオ医薬品パイプラインと上市ニーズの変化に伴い、細胞株開発に使用される技術やワークフローも様変わりしています。Beacon、AMBRシステム、Dyna Drive、MAMなどの革新的技術を用いることにより、申請にすぐ対応できる細胞株・細胞培養工程をより速やかにかつ効率的に開発することが可能です。手作業でのワークフローに比べ、革新的技術は労力を大幅に削減できるとともに、細胞株・細胞培養工程の質を大きく高めることができます。

オンデマンド ウェビナー
製剤開発における技術的課題の克服:医薬品開発製造受託機関(CDMO)の視点
製剤開発で直面する様々な技術的課題の解決をサーモフィッシャーサイエンティフィックはどのように支援しているのでしょうか?高い効果を持つ医薬品・製剤の承認取得と上市に貢献するソリューションをご紹介します。

オンデマンド ウェビナー
細胞治療製造のためのCDMOパートナーを選択する際の主な考慮点
細胞・遺伝子治療市場は、加速する市場承認、記録的な投資、強固な治療パイプライン、良好な臨床結果などを経験しており、これらすべてがスピード、規制ノウハウ、製造技術の革新の必要性を後押ししています。

オンデマンド ウェビナー
フォームと適合性。複雑な低分子を高性能な医薬品に変換するための統合したリソースの活用
各臨床段階から最大限の利益を得ようとした場合、統合的なサービスを提供することが可能な契約パートナーを活用することで実現することが可能です。

オンデマンド ウェビナー
医薬品開発への最適なアプローチ
サーモフィッシャーサイエンティフィックのQuick to Care™️プログラムでは、原薬・製剤開発、需要計画、臨床試験供給実行を単一のカスタマイズされたソリューションにまとめ、サプライチェーンを簡素化し、臨床開発を加速化させ、数か月の開発時間を短縮することが可能です。

オンデマンド ウェビナー
5KLバイオリアクターのメリット:バイオ医薬品原薬後期開発の外部委託
バイオ医薬品の培養工程における現在の課題の中でも特に重要なものとして、強化された細胞培養工程において混合・物質移動性能を向上させるにはバイオリアクターのスペースの制約が問題となること、また、需要量の変化に伴い柔軟かつ効率性の高い製造方法が必要とされることの2点が挙げられます。

オンデマンド ウェビナー
先端治療応用で使用するプラスミドDNAの製造戦略
「細胞・遺伝子治療市場は急速な投資とIND申請の増加を続けており、これらの画期的な治療法の開発に用いられる重要な原材料について、規制ガイドラインの適切な適用と製造戦略に関する新たな疑問が生じています。

ファクトシート
バイオ原薬 (Biologics)カタログ
複雑な高分子化合物の開発に伴う課題、リスク、コストは急増しています。競争優位を獲得するのは困難を極めます。バイオ医薬品の開発・製造に20年間携わってきた経験を基に、サーモフィッシャーサイエンティフィックは柔軟性の高い総合的なソリューション、深い専門知識、そして高度な技術力を提供いたします。

ファクトシート
クリニカル・アンシラリー・マネジメントサービス(臨床試験補助管理サービス)
サーモフィッシャーサイエンティフィックのCAM(Clinical Ancillary Management)サービスは、サプライチェーンの専門家チームが、臨床試験設定の初期計画段階から臨床試験の実施、試験終了に至るまで、お客様と共に課題を解決する、包括的かつ専門的なサプライチェーンマネージメントサービスです。
ファクトシート
サーモフィッシャー、外部委託化合物のNDA承認取得件数第1位を維持
パセオンの医薬品サービスが過去10年間にサポートしたお客様のNDA承認取得件数は、業界第2位以降3社の合計を上回っています。

ファクトシート
連続生産:バッチ生産に代わる生産方式
製薬業界に対するより良い品質、価格設定、生産性を求める圧力が高まり続ける中、従来のバッチ生産方式による経口固形製剤製造工程では、これらのニーズに十分に対応することはできません。

ファクトシート
商業包装サービス
治験用・商業用サプライチェーンのために複数の業者を管理するのは容易ではありません。配送状況の確認、規格を満たす包装、少量包装への対応など様々な課題が伴います。社内と同等の品質とサービスへのこだわりを持って作業に臨むパートナーであるかどうかも懸念されると、リスクはさらに高まります。

ファクトシート
経口剤開発のためのエンジニアード・ソリューション
エンジニアード・ソリューションは、医薬品原料、関連製造プロセス、製品、バイオ医薬品の特性、そしてそれらがどのように本質的に結びつき、お客様の医薬品開発の成功に不可欠であるかを検討することを通して、医薬品開発の包括的な視点を提供しています。

ファクトシート
低分子APIソリューション
スタンドアロンの API サービスが必要な場合でも、完全に統合されたエンドツーエンドの医薬品開発が必要な場合でも、当社はお客様のチームの延長として機能します。深い科学的専門知識、業界をリードするテクノロジー、グローバル ネットワークのバックボーンの力を組み合わせて、当社はお客様が目標に近づくよう全力を尽くします。

ファクトシート
ATLAS (代替翻訳およびラベル承認システム)
当社独自の Web ベースの代替翻訳およびラベル承認システム (ATLASSM) について学びます。これは、多言語ラベル テキストの開発を自動化および最適化する、検証済みの臨床ラベル翻訳管理サービスです。

ファクトシート
CTX ソリューション ファクトシート
細胞および遺伝子治療市場は、市場承認の機会の加速、記録的な投資、強力な治療パイプライン、良好な臨床結果を経験しており、これらすべてがスピード、規制上のノウハウ、製造技術の革新の必要性を促進しています。

ファクトシート
初期開発サービス
1つの候補化合物に取り組む企業であっても、グローバルファーマであっても、初期開発には、スピードとコスト効率に優れた、科学に基づくノウハウが必要です。パセオンはカスタマイズされた初期開発戦略と技術的ソリューションを構築し、複雑な開発課題の解決に貢献いたします。
ファクトシート
Quick to Care™:新規ベンチャー企業のお客様のための総合的医薬品開発・治験サービス
創製された高分子・低分子候補化合物の開発期間を数ヵ月短縮するサービス、Quick to Care™では、原薬・製剤開発、需要計画、治験薬供給をカスタマイズして一括サポートするソリューションを構築することにより、サプライチェーンをシンプル化し、臨床開発を加速させます。業界標準の開発期間15ヵ月を、低分子では8〜12週間、高分子では14〜20週間短縮することが可能です。

ファクトシート
mysupply Platform:総合的なデジタルサプライチェーンプラットフォーム
開発から上市まで、医薬品はダイナミックなグローバルサプライチェーンの中で供給されるため、変更や遅延が起こりがちです。

ファクトシート
Patheon™️ Quick to Clinic™️ ウィルスベクターサービス (IND申請の迅速化に向けた初期開発サービス)
Patheon™️ Quick to Clinic™️ ウイルスベクターサービスは、最大200Lまでの拡張性を持つレンチウイルスおよびAAV製造のための最適化されたIND申請対応プラットフォームプロセスを利用した統合された開発プログラムで、リスク管理および開発・製造時間の短縮を可能にします。

ファクトシート
優先運送業者管理の概要
当社のライフ サイエンス規格の配送が、温度管理および検証済みのトレーラーを含めるように独自に特化された優先運送業者ネットワークにどのように制限されているかをご覧ください。

ファクトシート
ウイルスベクターの充填・最終包装サービス
ウイルスベクターやウイルスワクチンの開発に取り組む新規ベンチャー企業、中規模・大手バイオ医薬品企業、研究機関のお客様向けの充填・最終包装サービスです。

ファクトシート
Quadrant 2™ 溶解性とバイオアベイラビリティの改善を実現する予測プラットフォーム
難溶解性の化合物は、低バイオアベイラビリティという課題をしばしば抱えており、原薬や製品の有効性を低下させる可能性があります。サーモフィッシャーサイエンティフィック独自のコンピューターモデリングプログラムQuadrant 2™は開発初期の診断ツールで、インシリコによる製剤の予測を見ることができます。

ファクトシート
サンプル配送&物流サービス
ライフサイエンス分野のロジスティクスのエキスパートである、パセオンロジスティクスは、製品の安全性と規制遵守を確保しつつ、最適な物流と輸送効率の向上を実現する独自のソリューションを提供いたします。

ファクトシート

ファクトシート
業界の専門家に支えられたグローバルの規制対応サービス
複雑な規制環境に対応することは、医薬品のライフサイクルを成功させるために不可欠です。サーモフィッシャーサイエンティフィックは、グローバルネットワークと経験豊富な規制当局への対応に熟知した専門家に支えられながら、それぞれの開発化合物や分子の特有のニーズや課題に容易に対応できる柔軟な規制ソリューションを幅広く提供しています。

ファクトシート
GMP細胞治療薬製造サービス
細胞・遺伝子治療市場は、市場における承認の機会が加速し、記録的な投資、強固な治療パイプライン、良好な臨床結果を経験しており、これらすべてがスピード、規制に関するノウハウ、製造技術の革新を必要としています。

ファクトシート
先進的な治療サプライチェーンソリューション
サーモフィッシャーサイエンティフィックは、カスタマイズされたパッケージングやラベリングから、患者サンプル、薬剤、細胞株の安全なコールドチェーン保管までのサービスを提供しています。

eBook
単なる購入・入手を超える:戦略的アプローチによる対照薬の調達
最高品質の対照薬を短いリードタイムで調達することは簡単ではありません。対照薬調達における課題を克服する方法の1つが、戦術的ではなく戦略的なアプローチを取ることです。

eBook

eBook
承認されたフレーズ ライブラリを構築する理由
承認されたフレーズ ライブラリがどのようにラベルのスケジュールを短縮し、品質を向上させ、法規制へのコンプライアンスを確保できるかを学びましょう。
eBook
温度逸脱を管理する:対応すべき重要事項
サプライチェーン全体にわたって低温輸送製品の完全性を維持するには、温度変化の影響を受けやすい治験薬の包装、取扱い、保管、輸送から治験実施医療機関への配送まで、厳密なプロセスと低温輸送に関する最高水準の専門知識が必要です。

eBook
低温を保つという課題:治験薬サプライチェーン全体をカバーするエンド・ツー・エンドの温度管理
医薬品は、製造現場から患者さんのもとに届くまで、有効性を保つために厳しい温度管理を行わねばなりません。

eBook
バイオ医薬品のさらなる成長: 投資家からよく聞かれる10の質問とその回答例
新薬のプログラムを構築する際に多くの重要な検討事項があり、その中でも最も重要なのは、次のマイルストーンに到達するための資金調達であることは間違いありません。

パンフレット
経口剤・注射剤(無菌製剤)サービス
経口固形製剤:従来型の製剤や特殊な経口固形製剤にも対応する幅広い技術とスケール。これらの剤形と様々な放出制御技術の革新的な組み合わせにより選択肢はさらに広がります。

パンフレット
バイオ医薬品開発・製造の技術力
バイオ医薬品企業のお客様のための総合的サービスをご紹介します。品質システムと継続的改善への取り組みを土台としたサービスにより、各マイルストーン達成を支援いたします。

パンフレット
すべての試験にグローバルな治験薬供給ソリューションを 適切な薬剤を適切な患者に、オンタイムで、すべてをカバーした妥協のないサービスの提供
競争の激しい新薬開発市場において、バイオファーマ企業は、コスト、時間、品質のバランスから、治験および患者における最大の結果を出すということまで、数々の課題に直面しています。

パンフレット
バイオ医薬品サービス:柔軟性の高いバイオ医薬品製造ソリューション
人々の生活を変え、未来を作る力を秘めた化合物。パセオンは、最高水準の品質を確保しつつ、早期上市に貢献するアジリティとスピードを提供できるパートナーです。
パンフレット
バイオ医薬品の開発・製造おけるスピードと柔軟性を実現する包括的な提案
バイオ医薬品の開発や製造における複雑さを取り除き、より早く、より少ないコストとリスクで、お客様の開発分子を市場に送り出すために、サーモフィッシャーサイエンティフィックの統合された、カスタマイズ可能なサービスをご利用ください。

パンフレット
治験薬供給ソリューション
治験薬供給管理において、開発リスクとコストを十分に理解し、事前に予測するうえで、治験薬供給の戦略的重要性が注目されています。合理化され、効率性と柔軟性の高い治験薬サプライチェーンを確保するには、事前の計画が極めて重要です。

パンフレット
細胞治療・遺伝子治療サプライチェーンのための輸送ソリューション
細胞治療・遺伝子治療の輸送では、医薬品の完全性を維持するとともに、スケジュールと所定の温度範囲を厳守して、目的地に確実に配送することが最優先事項です。

パンフレット
経口剤:柔軟性の高い様々な開発・製造ソリューション
経口剤の成功には、複雑な規制環境への対応、分析データの取得、プロセス開発・最適化、スケジュール厳守の作業のすべてを調整し円滑に進めることが不可欠です。

パンフレット
低分子原薬(API)ソリューション:全体を把握したアプローチとは
低分子原薬(API)のアウトソーシングには、それぞれの地域において競争力のある選択肢があるため、プロジェクトの複雑さにかかわらず、「適切なパートナー」を選択するのは至難の業です。

インフォグラフィック
2つの医薬品受託製造開発機関(CDMO):バイオ医薬品企業が選ぶべきCDMOとは?
バイオ医薬品の開発・製造における課題が増え続ける現在、適切なCDMO選びは極めて重要な事項です。DNA配列から上市まで、あらゆるチェックポイントに円滑に対応できる、経験豊かな信頼できるパートナーを選ばなければなりません。

インフォグラフィック
後期技術移転に成功するためのCDMOの5つの必要条件
後期技術移転のためにCDMOを検討する際には、5つの主要な特性を持つCMDOと提携することで成功に導くことができます。その5つの特性について説明します。

インフォグラフィック
小規模の製薬会社の大きな成功を支援: CDMOパートナーの企業規模は、バイオプロジェクトの選定に影響するのか?
開発初期における人材不足やプロセス開発の課題により、企業は、無菌製剤の開発・製造のパートナーとして小規模CDMOか大規模CDMOのどちらを選択すべきかという難しい決断を迫られることがよくあります。

インフォグラフィック

インフォグラフィック
決断のポイント:連続生産の自社での構築 VS 連続生産システムの購入
連続生産は、そのコスト削減効果により、業界内で急速に勢いを増し、採用が進んでいます。しかし、自社でスイートを構築すべきか、それとも購入すべきなのでしょうか。

インフォグラフィック

インフォグラフィック
治験薬サプライチェーンで起こりがちな5つの遅延に関する問題と問題を回避できるパートナーの選び方
臨床試験は非常に複雑なプロセスであるため、あらゆる側面について綿密な計画を立てる必要があります。

インフォグラフィック

ホワイトペーパー
技術移転。成功の最大化とリスク軽減のためのベストプラクティス
スケールアップのための製造拠点の変更であれ、開発から製造への移行であれ、技術移転はすべての医薬品が市場投入されるまでに通過しなければならない重要なプロセスです。 技術移転を成功させることで、生産性と効率の向上、プログラムコストの削減、規制対応力の最適化、そして市場投入までの時間の短縮を実現することができます。こちらの資料では、よくある落とし穴、ベストプラクティス、次の技術移転を成功させるための重要な要素について説明しています

ファクトシート
初期開発サービス
1つの候補化合物に取り組む企業であっても、グローバルファーマであっても、初期開発には、スピードとコスト効率に優れた、科学に基づくノウハウが必要です。パセオンはカスタマイズされた初期開発戦略と技術的ソリューションを構築し、複雑な開発課題の解決に貢献いたします。

オンデマンド ウェビナー
バイオ医薬品の開発を加速させる: ラボからクリニック、そして市場へ
サーモ フィッシャー サイエンティフィックが、新進気鋭のバイオテクノロジー企業をより迅速に臨床現場に投入し、市場に投入するためにどのようにサポートしているかをご覧ください。

ブログ
Panteli Theocharous
Global Vice President, Cell and Gene Therapy Strategy lead at PPD, part of Thermo Fisher Scientific.
Scientific Expertise:
- Cell and Gene therapy
- Cancer Immunotherapy expert
Focus Area
Stem Cell Transplantation,
Cell and Gene Therapies
JACIE – The
Joint Accreditation Committee of the International Society for Cellular Therapy (ISCT) and
the European Group for Blood and Marrow Transplantation (EBMT) Inspector
Credentials
M.S. in Applied Clinical Hematology ,University of London
Cancer medicine related higher degrees, University of London

ブログ
Sara Sheriff
VP of Integration/ Engineering Operations Services Optimization Leader
Scientific Expertise:
- Integration
- Engineering Operation Services optimization
- digital platforms
- Operations and manufacturing
Focus Area
Operations/ Supply Chain Excellence and Business Process/Digital Transformation
Credentials
test

ブログ
Clara Ferloni
Sr Manager, EU Regulatory Affairs, Thermo Fisher Scientific
Scientific Expertise:
- Regulatory
- Chemistry, Manufacturing and Controls (CMC)
- Clinical and Commercial products
- EU Regulatory Affairs
Focus Area
Regulatory Affairs, supporting, amongst others, sites specialized in the manufacture of biological products.
Credentials
PhD in enzyme technology

ブログ
Jennifer A Head, PhD
Manager of Regulatory Affairs, Microbial Manufacturing Services (MMS)
Scientific Expertise:
- Regulatory strategy for marketing of controlled substances, new molecular entities, and new chemical entities
- Regulatory intelligence and interpretation of regulatory guidance
- Developing, editing, and reviewing regulatory submissions
- Cell and gene therapy CMC expert
- Microbiology and immunology
- Viral pathogenesis
- Medical technology
- Central nervous system and oncology pharmaceuticals
Focus Area
Biologics
Credentials
Jean B. Kempner Postdoctoral Fellow and Ruth L. Kirschstein National Research Service Award Institutional Research Training Grant recipient, Doctor of Philosophy in Microbiology and Immunology from University of Texas Medical Branch, Bachelor of Science degree in Medical Technology from University of Texas MD Anderson Cancer Center School of Health Professions, Bachelor of Science degree in Biology from Texas A&M University Corpus Christi

ブログ
Kaspar van den Dries, PhD
Senior Director Science and Innovation, Softgels
Scientific Expertise:
- Formulation & process development
- Solid dose formulation (tablets, capsules, and softgels)
- Late stage process development projects
- Technology transfer
- Regulatory filings
- Solubility enhancement
- Biopharmaceuticals
- Lipid-based formulations
- Quality by design
- Risk assessment and experimental designs
- Process analytical technologies (NIR)
- In vitro – in vivo relationships
Focus Area
Softgels
Credentials
Doctor of Philosophy and Master’s degree in pharmaceutical sciences from the University of Utrecht, NL

ブログ
Richard Snyder, PhD
Vice President, Science and Technology
Scientific Expertise:
- Oral solid dosage forms, tablets, hard shell capsules, and softgels
- Virus biology
- Viral vector development
- cGMP viral vector manufacturing & analytical technologies
- Viral vector mediated gene transfer
- Development of novel viral vector-based human gene therapies
Focus Area
Viral Vector Services
Credentials
Post-doctoral fellow at Johns Hopkins University School of Medicine
Doctor of Philosophy in microbiology from The State University of New York at Stony Brook
Bachelor’s degree in biology from Washington University in St. Louis

ブログ
Peter Poechlauer, PhD
Innovation Manager, Small Molecule API
Scientific Expertise:
- Product development
- Small molecules
- Green chemistry
- Process technology
- Continuous manufacturing & analytics
- Process Intensification
- Organic chemistry
- Biocatalysis
Focus Area
API (small molecule)
Credentials
Doctor of Natural Sciences in organic chemistry & pharmaceutical chemistry from Innsbruck University in Austria

ブログ
Ronald Perry
Senior Manager, R&D
Scientific Expertise:
-
Formulation, technical transfer, and process optimizations for:
- Oral solid dosage forms, tablets, hard shell capsules, and softgels
- Oral liquids (solutions, suspensions, extended release suspension)
- Transdermal systems
- Sterile injectables
- Ophthalmic
- Medical device
- Aerosol products
- Packaging
- Creams and ointments
- Quality assurance experience including site auditing (domestic and international)
- Pharmacy/pharmaceutical consultant services ad libitum
Focus Area
Softgels
Credentials
Pre-med/pharmacy degree from Indiana University South Bend, IN
Bachelor of Science, Pharmacy from Purdue University School of Pharmacy in West Lafayette, IN
Studied diabetes education and anticoagulation therapy
Immunization certified
Registered Pharmacist (R.Ph.)

ブログ
Sanjay Konagurthu, PhD
Senior Director, Science and Innovation
Scientific Expertise:
- Product development
- Oral drug delivery
- Drug product development
- Pre-formulation, formulation, process development, scale-up, tech transfer, and commercialization
- Solubility enhancement technologies
- Amorphous solid dispersions by spray-drying
- Hot-melt extrusion
- Size-reduction
- Lipid-based systems
- Complexation
- Oral modified release
- Multiparticulate delivery
- Osmotic delivery
- Taste masking
- Fast-dissolving dosage forms
- Lifecycle management
- Designing novel drug delivery systems
- Nano-milling
- Process miniaturization
- Process development and scale-up
- Novel process design & implementation
- Design of experiments
- Technology transfer
Focus Area
Formulation and development
Credentials
Doctor of Philosophy in chemical engineering from the University of Colorado in Boulder
Bachelor’s degree in chemical engineering from the Indian Institute of Technology Madras (Chennai)

ブログ
Anil Kane, PhD, MBA
Senior Director, Global Technical and Scientific Affairs
Scientific Expertise:
- Product development
- Small molecules
- Pre-formulation, clinical development to lifecycle management
- Scientific strategic planning/problem solving
- Early development
- Clinical supplies
- Technology transfer
- Supporting chemistry, manufacturing, and controls documentation
Focus Area
Formulation and development
Credentials
Doctor of Philosophy from the University of Bombay, India
Master of Business Administration from Richard Ivey School of Business, University of Western Ontario, Canada
Post Doctoral research at the University of Cincinnati

ブログ
Kevin Shea
Senior Label Program Director
Expertise:
- Clinical supplies, with expertise in clinical labels, label translation and regulatory services
- Customer oversight/maintenance
- Customer liaison
- New business
- Bid defences
- Issue Resolving
- Webinars, Workshops, Presentations, and Whitepapers
- Trade shows
- Escalations
- Technical support
- Training, Quality and Audit support
Focus Area
Clinical label services
Clinical trial services
Credentials
Bachelor's Degree, Hobart College

ブログ
Julie Hoffman
Senior Director of Commercial Strategy and Execution
Focus Area
Clinical ancillary management
Clinical trial services

ブログ
Janet Williams
Senior Director, Global Supply Chain Management
Focus Area
Clinical ancillary management
Clinical trial services

ブログ
Iain McGroarty
Senior Business Development Executive, API Europe
Focus Area
API (small molecule)

ブログ
Elena Gontarz, PhD
Manager, Scientific and Technical Affairs
Focus Area
Biologics (large molecule)

ブログ
Daniel Baskind
Manager, Scientific and Technical Affairs
Focus Area
Biologics (large molecule)

ブログ
Jason Mieding
Senior Director, Logistics
Scientific Expertise:
- Highly experienced in supply chain with a particular focus on sales and operations planning, transportation and logistics management, and system enhancements including SAP
- Certified in production and inventory management (American Production and Inventory Control Society)
- Multi-functional leadership experience in manufacturing, quality, and technical areas within pharmaceutical GMP environments
Focus Area
Logistics
Credentials
Bachelor’s degree in production and operations management from Ohio State

Expert
Kevin Kane, PhD
Senior Staff Scientist, R&D
Scientific Expertise:
- Oral drug delivery
- Drug product development
- Pre-formulation, formulation, process development, scale-up, tech transfer, commercialization
- Phase appropriate dosage forms for preclinical and clinical studies
- Solubility enhancement technologies
- Amorphous solid dispersions by spray-drying, hot-melt extrusion and complexation
- Size-reduction and lipid-based systems
- Oral modified release
- Multiparticulate and osmotic delivery
- Matrix tablets
- Lipid modified release
- Injectable drug delivery
- Formulation development for solution and lyophilized vials for small molecules
- IV and depot formulations
- Powder-filled vials
- Technology transfer
Focus Area
Commercial manufacturing
Credentials
Doctor of Philosophy in inorganic chemistry from Ohio University
Post-doctoral Fellow and Visiting Assistant Professor of chemistry at the University of Idaho
Master’s and Bachelor’s degrees in chemistry (polymer and materials) from Texas State University

ブログ
Gordon Hutton, PhD
Materials Science Lead
Scientific Expertise:
- Organic chemistry
- Crystallization processes for commercial applications
- Materials science expert
- API development
- Commercial manufacturing
Focus Area
API (small molecule)
Credentials
Doctor of Philosophy in synthetic organic chemistry from the University of Cambridge, U.K.
Bachelor’s degree in pure & applied chemistry from Strathclyde University in Glasgow, U.K.

ブログ
Jeff Hou, PhD
Director and Site Head, Scientific & Technical Affairs
Scientific Expertise:
- Biologics development
- Cell line development
- Process development
- Tech transfer
- GMP manufacturing
- Cell biology
- Lead candidate discovery
Focus Area
Biologics (large molecule)
Credentials
Doctor of Philosophy in biotechnology from The University of Queensland
Bachelor’s degree in advanced sciences from the University of New South Wales

ブログ
Douglas Hausner, PhD
Senior Manager, Continuous Manufacturing
Scientific Expertise:
- Continuous manufacturing
- Process analytical technology
Focus Area
Commercial manufacturing
Credentials
Doctor of Philosophy in physical chemistry from Temple University
Bachelor’s degree in chemistry from the University of Delaware

ブログ
Christy Eatmon
Senior Staff Scientist, R&D
Scientific Expertise:
- Extensive experience in pre-clinical to early phase formulation development of sterile products
- Process engineering expertise to enable technology transfer and scale up of parenteral formulations
- High level knowledge of all phases from drug discovery to commercial manufacturing and commercial launch
- Extensive experience with both small and large molecules, including small molecule formulation for controlled release of poorly water-soluble drugs
Focus Area
Steriles
Credentials
Bachelor’s degree in chemistry from Moravian College in Pennsylvania

ブログ
Monica Commerford, PhD
Head of Viral Vector Services Regulatory Affairs
Scientific Expertise:
- Cell and gene therapy CMC expert
- Microbiology and molecular genetics
- Microbial control, Product Quality microbiology, and Sterility Assurance for investigational new drug and marketing applications
- Developing, editing and reviewing regulatory submissions, including reviews as a health authority assessor
- Regulatory intelligence and interpreting regulatory guidance
Focus Area
Viral Vector Services
Credentials
Sallie Rosen Kaplan Post-Doctoral Fellow, National Cancer Institute, National Institutes of Health
Doctor of Philosophy in Microbiology and Molecular Genetics from Harvard University
Bachelor’s degree in Biochemistry and Molecular Biology from Michigan State University

Video
The Journey from Molecule to Medicine
It all starts with your discovery. A molecule, small or large, that needs a partner. Let Patheon be that partner.

Video
The “Eureka Moment” That Helped a Small Company Make a Big Impact
Tony and the team at Thermo Fisher Scientific understand the needs of small and emerging companies.

Video
Solved With: Capacity and Compassion
Learn how Thermo Fisher Scientific was able to help this company solve one of their biggest challenges in the drug development process.

Video
Our Formulation of Heart and Science is the Key to Our Success
At Thermo Fisher Scientific, everything we do is made with the right balance of heart and science. Find out how Angie and our Fisher Clinical Services team went above and beyond to overcome tough obstacles in order to ensure thousands of patients around the globe received life-saving medications.

Video
One Bottle of Hope for One Amazing Kid
Meet Gavin and his mom, Nicole. Learn how Gavin’s battle with a brain tumor led him to the bottle of hope that allowed him to be a kid again.

Video
Made For: Hope for ALS
Learn how Amylyx Pharmaceuticals partners with Thermo Fisher Scientific to bring hope to patients with ALS.

Video
How Thermo Fisher is Battling COVID-19
We are proud to be on front lines arm-in-arm with our clients, fighting COVID-19. Together, we will win. Every patient matters.

Video
How Spring Break Had to Wait a Little Longer, So a Baby Could Have a Better Shot
After a long night of packing for her family’s spring break vacation, Holli woke up at 4:40 AM Saturday morning. She noticed a text message on her phone.

Video
How Speaking a Third Language Helped Win the Race to Market
Several Chinese pharmaceutical companies were competing to be first to market. And second place didn’t matter.

Video
How One Split-Second Decision Made a Difference for Thousands of Patients
In the world of drug manufacturing not all life-saving decisions happen in the lab. Sometimes it’s a lot closer to delivery that key moments require fast thinking.

Video
How Leveraging a Global Network Delivered Big Results
Mike’s team in Bend, OR was only supposed to optimize the spray drying process for a particular medication while another, much larger, facility would handle the large-scale manufacturing. However, the other facility’s equipment wouldn’t be available in time to meet the client’s aggressive IND filing schedule.

Video
How Can Pharma Companies Save up to $45M in Early Drug Development?
Patheon’s Jennifer Therrien discusses findings of a Tufts Center for the Study of Drug Development (CSDD) study that reveals how pharmaceutical companies using a single-source outsourcing partner can achieve a net gain of $45 million in early drug development.

Video
How a Viral Vector Got the Boost It Needed to Start Defeating an Incurable Disease
Duchenne’s Muscular Dystrophy is an incurable disease that mostly affects boys. It results from a gene defect that prevents those affected from developing normal muscle structure and function.

Video
How a Family’s Perseverance Helped Them Reach a Seemingly Unattainable Goal
As members of the United States Air Force, Lauryn and Chris were as healthy and fit as a young couple could be. But in the world of genetics, all it takes is a couple of proteins lining up in the wrong way, and things can change in a hurry.

Video
How a Combination of Medicines Helped One Man Take Back His Life, and Inspired Us All
On a quiet Sunday afternoon, Pete and his wife Lisa took a moment to sit on a porch swing and relax. A small piece of wood holding the chain broke and they fell backwards causing Pete to break his neck.

Video
Going the Extra Mile is Part of Our DNA
The stakes were high for a client who needed material for a novel drug to in order to proceed to clinical trial. With millions of dollars on the line, Jeff’s team had one shot to develop a process to scale up or risk failing the batch.

Video
Delivered With: Partnership and Passion
Learn why this supply chain executive calls Thermo Fisher Scientific the CDMO partner of choice.

Video
Delivered With: A Positive Client Experience
Learn how a global CDMO never loses sight of what’s important to our clients.

Video
Collaboration and Knowledge Transfer Equals Success for Patients
Collaboration is an important part of our culture at Thermo Fisher Scientific and it starts with our people. Emily and Jessica are a great example of how a mentor relationship facilitates the transfer of critical knowledge to achieve long-term results.

Video
The Medicine Maker, Chapter 6: Leading Industry Transformation
Video Webinar with The Medicine Maker, Chapter 6: Leading Industry Transformation.

Video
The Medicine Maker, Chapter 5: Planning for Insourcing or Outsourcing
Video Webinar with The Medicine Maker, Chapter 5: Planning for Insourcing or Outsourcing.

Video
The Medicine Maker, Chapter 4: Measuring Forecast Accuracy
Video Webinar with The Medicine Maker, Chapter 4: Measuring Forecast Accuracy.

Video
The Medicine Maker, Chapter 3: Identifying Volatile Forecast Variables
Video Webinar with The Medicine Maker, Chapter 3: Identifying Volatile Forecast Variables.

Video
The Medicine Maker, Chapter 2: Overcoming Commercial Launch Challenges
Video Webinar with The Medicine Maker, Chapter 2: Overcoming Commercial Launch Challenges.

Video
The Medicine Maker, Chapter 1: Understanding Industry Shifts
Video Webinar with The Medicine Maker, Chapter 1: Understanding Industry Shifts.

Video
Thermo Fisher Scientific & CSL Enter Strategic Partnership to Provide Best-in-Class Pharma Services
We are pleased to announce that Thermo Fisher Scientific and global biotechnology company CSL have entered into a strategic partnership to help meet the growing demand for biologic therapies while also accelerating CSL’s broader manufacturing objectives.

Video
Patheon’s Softgel Expertise
Learn more about the Softgel expertise at Patheon, by Thermo Fisher Scientific.

Video
Clinical and Commercial Manufacturing for Oral Solid Dose in Greenville, North Carolina
Clinical and Commercial Manufacturing for Oral Solid Dose in Greenville, North Carolina.

Video
API to Clinical Trial Distribution: The Value of Patheon’s Integrated Offering
From preclinical to clinical trial distribution to commercial manufacturing, we can help you through the entire process.
























